以醫(yī)療器械作用為主的藥械組合產(chǎn)品中藥物定性���、定量及體外釋放研究注冊審查指導(dǎo)原則
目前,以醫(yī)療器械作用為主的藥械組合產(chǎn)品(本指導(dǎo)原則簡稱為藥械組合醫(yī)療器械)中�,藥物與醫(yī)療器械組合形式主要是將藥物與醫(yī)療器械進(jìn)行物理結(jié)合(如混合、涂覆等)或化學(xué)鍵合等�����。常見的藥械組合醫(yī)療器械有帶藥物涂層的支架����、帶抗菌涂層的導(dǎo)管���、含藥避孕套、含藥節(jié)育環(huán)等�。
本指導(dǎo)原則旨在幫助和指導(dǎo)申請人開展藥械組合醫(yī)療器械產(chǎn)品注冊申報(bào)資料中的藥物定性、定量及體外釋放研究���,以滿足技術(shù)審評的基本要求����,同時(shí)有助于審評機(jī)構(gòu)對該類產(chǎn)品進(jìn)行科學(xué)規(guī)范的審評��,提高審評工作的質(zhì)量和效率�����。
本指導(dǎo)原則雖然為該類產(chǎn)品提供了初步指導(dǎo)和建議���,但不會限制醫(yī)療器械相關(guān)管理部門及該類產(chǎn)品的技術(shù)審評���、行政審批,以及申請人對注冊申報(bào)資料的準(zhǔn)備。由于該類產(chǎn)品品種多樣�����,申請人可依據(jù)具體產(chǎn)品的特性對資料進(jìn)行充實(shí)和細(xì)化�����。
本指導(dǎo)原則是在現(xiàn)行法規(guī)以及當(dāng)前認(rèn)知水平下制訂的���,隨著法規(guī)的不斷完善,以及藥械組合醫(yī)療器械產(chǎn)品技術(shù)的發(fā)展和提高�����,本指導(dǎo)原則相關(guān)內(nèi)容也將進(jìn)行適時(shí)地調(diào)整����。
一、適用范圍
本指導(dǎo)原則涉及的藥械組合產(chǎn)品系指由藥品與醫(yī)療器械共同組成��,并作為一個(gè)單一實(shí)體生產(chǎn)的醫(yī)療產(chǎn)品��,其中以醫(yī)療器械作用為主的藥械組合產(chǎn)品按照醫(yī)療器械有關(guān)要求申報(bào)注冊��,簡稱藥械組合醫(yī)療器械���。
本指導(dǎo)原則適用于藥械組合醫(yī)療器械的藥物定性����、定量及體外釋放研究,可為此類產(chǎn)品的研發(fā)���、注冊申報(bào)���、技術(shù)審評等環(huán)節(jié)提供參考。
本指導(dǎo)原則不適用于以藥品作用為主的藥械組合產(chǎn)品��。
二���、研究內(nèi)容
保證藥械組合醫(yī)療器械的安全����、有效����、質(zhì)量可控是研發(fā)和評價(jià)應(yīng)遵循的基本原則。藥械組合醫(yī)療器械中����,所含藥物起輔助作用��,需整體評估組合產(chǎn)品的新增風(fēng)險(xiǎn)和風(fēng)險(xiǎn)受益比�����,充分考慮藥物部分和器械部分的相互作用帶來的影響,考慮藥物部分較其單獨(dú)使用時(shí)給藥途徑�、劑量、預(yù)期作用等可能發(fā)生變化及帶來的影響�����,因此建議基于藥物和醫(yī)療器械的組合形式及臨床預(yù)期用途�,對該類產(chǎn)品進(jìn)行藥物相關(guān)性能的研究,如藥物的定性����、定量及體外釋放等。
一般情況下��,藥械組合醫(yī)療器械產(chǎn)品需進(jìn)行藥物定性���、定量研究���。對于通過將藥物釋放到預(yù)期部位(如采用緩釋���、控釋或其他釋放方式)而發(fā)揮效用的產(chǎn)品,如帶藥物涂層的支架���、帶藥球囊擴(kuò)張導(dǎo)管��、含銀敷料等���,需進(jìn)行藥物體外釋放研究。對于不通過將藥物釋放到預(yù)期部位而發(fā)揮效用的產(chǎn)品��,如通過共價(jià)鍵結(jié)合添加肝素的人工血管等���,則無需進(jìn)行藥物體外釋放研究��,但可通過體外釋放研究評估產(chǎn)品的穩(wěn)定性��、涂層牢固度等����。
添加有生物活性物質(zhì)的產(chǎn)品��,如含生物活性物質(zhì)的骨科器械和含肝素涂層的器械,需根據(jù)其作用機(jī)理開展相關(guān)研究�����,對主要成分進(jìn)行鑒定�,可通過含量、活性���、效價(jià)等形式的研究進(jìn)行定性、定量��。
申請人可根據(jù)產(chǎn)品的組合形式����、預(yù)期用途、藥物作用方式等參照此原則�,選擇合適的研究內(nèi)容。
本指導(dǎo)原則是對藥械組合醫(yī)療器械藥物定性�����、定量及體外釋放研究的一般要求����,對于具體產(chǎn)品���,若有專門的指導(dǎo)原則或標(biāo)準(zhǔn),建議參考相應(yīng)的指導(dǎo)原則或標(biāo)準(zhǔn)的具體要求����。申請人應(yīng)依據(jù)組合產(chǎn)品的具體特性和研究目的對注冊申報(bào)資料的內(nèi)容進(jìn)行充實(shí)和細(xì)化,并對在研究過程中評價(jià)技術(shù)的設(shè)計(jì)����、實(shí)施及結(jié)果應(yīng)用的科學(xué)性和合理性進(jìn)行充分的闡述。
三�����、藥物定性����、定量、體外釋放及方法學(xué)驗(yàn)證
(一)藥物定性�����、定量
藥物定性的目的在于確定被分析物是目標(biāo)物�����,而非其它物質(zhì)。用于鑒別的分析方法應(yīng)具有較強(qiáng)的專屬性�。藥物定量的目的在于準(zhǔn)確測定藥械組合醫(yī)療器械產(chǎn)品中所載藥物的量。常用的分析方法包括理化方法及生物學(xué)方法等��。
藥物定性�����、定量分析方法應(yīng)優(yōu)先選用標(biāo)準(zhǔn)方法����,如國際標(biāo)準(zhǔn)、國家標(biāo)準(zhǔn)等����,在使用上述方法之前�����,可參照中國藥典四部中9099《分析方法確認(rèn)指導(dǎo)原則》��、9100《分析方法轉(zhuǎn)移指導(dǎo)原則》和9101《分析方法驗(yàn)證指導(dǎo)原則》等指導(dǎo)原則中規(guī)定的方法進(jìn)行方法確認(rèn)或轉(zhuǎn)移�,以確保方法的適用性。如果無適用方法���,可參照由知名技術(shù)組織或有關(guān)科技文獻(xiàn)或期刊中公布的方法�,開發(fā)適宜的新方法并進(jìn)行全面的方法學(xué)驗(yàn)證。在某些情況下���,如原材料的合成工藝改變����、分析方法中某些參數(shù)發(fā)生改變?nèi)缟V柱型號�����、流動相�、柱流速等,應(yīng)考慮是否需要對分析方法再次進(jìn)行全面的或部分的驗(yàn)證��,以確保分析方法可行�。
對于可以直接在器械上或采用產(chǎn)品原液進(jìn)行藥物定性和定量進(jìn)行試驗(yàn)的產(chǎn)品,可直接進(jìn)行產(chǎn)品的藥物定性�、定量研究;需將藥物從醫(yī)療器械中浸提(洗脫或分離)出來或適當(dāng)稀釋后進(jìn)行試驗(yàn)的產(chǎn)品�,提供浸提液/稀釋液制備及分析方法確定的依據(jù)。
建議申請人根據(jù)藥物性質(zhì)���、組合形式�����、器械材質(zhì)等產(chǎn)品特性��,選擇合適的處理方法并論述其適用性�����。對于需浸提后進(jìn)行分析的產(chǎn)品�����,浸提液制備及分析方法可參照以下內(nèi)容開展研究�����。
1.浸提液的制備
選擇終產(chǎn)品進(jìn)行試驗(yàn)����,浸提樣品宜盡可能選取所有含藥部位���,如截取含藥組件的部分進(jìn)行浸提����,需論述其合理性?����?疾煲蛩赝ǔ0ǎ?/span>
(1)浸提溶劑:需考慮藥物的溶解性��、穩(wěn)定性等�,尤其是具有生物活性的物質(zhì)在浸提液制備過程中應(yīng)避免其活性的改變。
(2)浸提比例:宜使溶液中藥物濃度保持在適宜的范圍內(nèi)����。
(3)浸提程度:適用的制備方法應(yīng)確保所含藥物洗脫完全,以達(dá)到極限浸提為原則���。
(4)浸提方式:可采取靜置����、振蕩���、超聲�����、回流等方式�����。必要時(shí)���,可根據(jù)不同分析儀器及方法的要求���,對浸提液處理(如離心、過濾等)后進(jìn)行測定�����。
除此之外����,基于分析手段的多樣性,也可先對藥物進(jìn)行衍生���、酸解���、酶解等處理后���,進(jìn)行測定����。
2.分析方法
根據(jù)產(chǎn)品中所含藥物的種類及分子結(jié)構(gòu)、理化性質(zhì)�、生物活性等,選擇適宜的定性����、定量方法。藥物定性一般與定量同時(shí)進(jìn)行��,常見的分析方法包括高效液相色譜法(HPLC)�����、紫外-可見分光光度法(UV-Vis)等�。如含有紫杉醇、雷帕霉素���、鹽酸利多卡因等藥物的醫(yī)療器械,可采用上述兩種方法進(jìn)行分析���。
采用高效液相色譜法時(shí),可以通過保留時(shí)間(tR)和/或光譜相似度定性。用于定量時(shí)��,可通過測定峰面積�,使用內(nèi)標(biāo)法或外標(biāo)法等進(jìn)行計(jì)算�。
采用紫外-可見分光光度法時(shí)���,可以通過特定波長范圍內(nèi)光譜圖��、最大吸收波長(λmax)或兩個(gè)特定波長處的吸光度比值而定性。用于定量時(shí)����,可在特定波長處測定吸光度,使用對照品比較法或吸收系數(shù)法等進(jìn)行計(jì)算��。
除此之外�����,其他的分析方法也可用于藥物的定性、定量分析����,如藥物官能團(tuán)的特異性反應(yīng)���、原子吸收分光光度法(AAS)、電感耦合等離子體發(fā)射光譜(ICP)���、氣相色譜法(GC)、質(zhì)譜法(MS)等����,如含銀的醫(yī)療器械,可采用原子吸收分光光度法�、電感耦合等離子體發(fā)射光譜法或電感耦合等離子體發(fā)射光譜-質(zhì)譜法進(jìn)行分析�。
(二)藥物體外釋放
藥物體外釋放是在適宜的條件下�����,對藥械組合醫(yī)療器械進(jìn)行的藥物體外釋放速率及釋放量的試驗(yàn)�����。其目的是考察藥械組合醫(yī)療器械中藥物在體外的釋放情況及其規(guī)律���,對生產(chǎn)工藝和產(chǎn)品質(zhì)量進(jìn)行控制,同時(shí)也可為動物試驗(yàn)和臨床評價(jià)提供參考����。
合理的藥物體外釋放行為是藥械組合醫(yī)療器械質(zhì)量控制的重要指標(biāo)��,對于保證產(chǎn)品臨床使用的安全性和有效性具有重要意義�。體外釋放試驗(yàn)宜論證與體內(nèi)釋放試驗(yàn)的關(guān)聯(lián)性��,考慮產(chǎn)品臨床使用情況���,也可根據(jù)試驗(yàn)需求,進(jìn)行加速釋放試驗(yàn)��。
一般情況下����,藥物體外釋放試驗(yàn)通過測定藥械組合醫(yī)療器械在各時(shí)間點(diǎn)藥物的釋放率��,來表征藥物的體外釋放行為����。釋放率可通過釋放到介質(zhì)中藥物的含量和/或釋放試驗(yàn)后產(chǎn)品上剩余藥物含量計(jì)算而得��。
在藥物體外釋放試驗(yàn)中,應(yīng)至少考慮以下因素:
1.試驗(yàn)樣品
選擇終產(chǎn)品進(jìn)行試驗(yàn)����,宜盡可能選取所有含藥部位�,如截取含藥組件的部分進(jìn)行浸提應(yīng)論述其合理性?���?蛇m當(dāng)增加測試樣品數(shù)量以降低樣品差異性引起的數(shù)據(jù)偏差��。
2.釋放溫度
根據(jù)產(chǎn)品的預(yù)期使用部位���,參考各國藥典中相應(yīng)內(nèi)容,選擇合適的溫度���。如無特殊要求�����,通常選擇 37 ℃ ±1 ℃模擬人體正常體溫����,32 ℃±1 ℃模擬表皮溫度��。
3.釋放介質(zhì)
根據(jù)藥械組合醫(yī)療器械預(yù)期使用部位的生理環(huán)境以及藥物理化性質(zhì)等因素確定釋放介質(zhì),如生理鹽水��、磷酸鹽緩沖液��,或添加表面活性劑、有機(jī)溶劑���、防腐劑�����、含相關(guān)生物酶的釋放介質(zhì)�����、血清等。
4.時(shí)間點(diǎn)設(shè)置
時(shí)間點(diǎn)的設(shè)置需充分考慮產(chǎn)品中藥物在臨床的釋放情況���。對于需要在體內(nèi)快速釋放的藥物(如帶藥球囊擴(kuò)張導(dǎo)管等)可設(shè)置一個(gè)時(shí)間點(diǎn)考察體外釋放情況。對于需要緩釋的器械(如帶藥物涂層的支架等)���,建議至少涵蓋藥物釋放的初始階段、中間階段和最后階段�����。初始階段為藥物釋放的活躍期�����,用于考察是否存在突釋效應(yīng);中間階段用于確定釋藥特性�����;最后階段表現(xiàn)藥物釋放的穩(wěn)定期(又稱平臺期)����,用于考察藥物釋放是否完全���,如冠狀動脈藥物洗脫支架一般要求至少釋放80 %標(biāo)稱藥物含量時(shí)達(dá)到平臺期�。如果體外釋放預(yù)期為非全部釋放��,釋放時(shí)間宜考慮能覆蓋藥物洗脫量達(dá)到穩(wěn)定的時(shí)間點(diǎn)。
藥物體外釋放試驗(yàn)中��,藥物的測定方法一般與定量方法一致�,也可采用其他經(jīng)驗(yàn)證的方法�����。如果藥物為避光藥物�����,應(yīng)關(guān)注藥物的避光要求��。
(三)方法學(xué)驗(yàn)證
方法學(xué)驗(yàn)證的目的是證明建立的方法適合于相應(yīng)檢測的要求�����,根據(jù)研究目的,可能需要的驗(yàn)證指標(biāo)有專屬性���、準(zhǔn)確度、精密度����、檢測限���、定量限、線性���、范圍、耐用性等����。對于含有生物活性物質(zhì)的生物學(xué)測定方法驗(yàn)證需參照相關(guān)指導(dǎo)原則開展方法學(xué)驗(yàn)證����。
需要說明的是�����,在方法開發(fā)和驗(yàn)證過程中�����,需要考慮基質(zhì)效應(yīng)的影響��。基質(zhì)效應(yīng)指的是在對分析物的濃度或質(zhì)量測定過程中����,來自樣品中一種或幾種其他化合物的綜合影響�����。需驗(yàn)證在采用開發(fā)的方法對藥物進(jìn)行測定時(shí)�,不會因其他成分的存在而對擬研究藥物造成干擾。
1. 專屬性
專屬性系指在其他成分(如雜質(zhì)�、降解產(chǎn)物�����、基質(zhì)等)可能存在下����,采用的分析方法能正確鑒定�、檢測出被測物的能力��。宜采用適宜的方法對專屬性進(jìn)行驗(yàn)證����,并排除其他成分的影響����,如色譜方法中�,應(yīng)附典型圖譜���,標(biāo)明被測物的位置����,且分離度符合相應(yīng)要求���。
藥物定性、定量���、體外釋放研究的測定方法,均應(yīng)考察其專屬性����。如專屬性不強(qiáng)��,應(yīng)采用一種或多種不同原理的方法予以補(bǔ)充�。
2. 準(zhǔn)確度
準(zhǔn)確度系指用所建立方法測定的結(jié)果與真實(shí)值或參比值接近的程度��,通常用回收率來評價(jià)��。準(zhǔn)確度應(yīng)在規(guī)定的線性范圍內(nèi)試驗(yàn)��。
用于回收率試驗(yàn)的樣品宜采用不含待測成分的空白樣品�,可以采用加標(biāo)回收率試驗(yàn)�����。根據(jù)分析目的和樣品的濃度范圍�����,在以下兩種方法中任選其一:(1)在規(guī)定范圍內(nèi),取同一濃度(相當(dāng)于100 %濃度水平)的供試品���,用至少6份樣品的測定結(jié)果進(jìn)行評價(jià);(2)設(shè)計(jì)3種不同的濃度��,覆蓋線性范圍的高����、中�����、低濃度并考慮樣品的濃度范圍�����,每種濃度分別制備至少3份供試品溶液進(jìn)行測定���,計(jì)算回收率����。
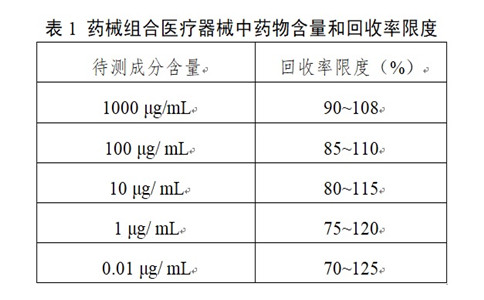
不同分析水平的可接受回收率也不同。樣品中待測成分含量和回收率限度關(guān)系可參考表1��。在基質(zhì)復(fù)雜�、組分含量較低及多成分等分析中�����,回收率限度可適當(dāng)放寬���。
表1 藥械組合醫(yī)療器械中藥物含量和回收率限度
3. 精密度
精密度系指在規(guī)定的測定條件下�����,同一份均勻供試液�����,經(jīng)多次取樣測定所得結(jié)果之間的接近程度�����。精密度一般用偏差�、標(biāo)準(zhǔn)偏差或相對標(biāo)準(zhǔn)偏差表示��。
藥物定量測定應(yīng)考察方法的精密度�。根據(jù)分析目的和樣品的濃度范圍����,在以下兩種方法中任選其一:
(1)在規(guī)定范圍內(nèi)�,取同一濃度(相當(dāng)于100 %濃度水平)的供試品�����,用至少6份樣品的測定結(jié)果進(jìn)行評價(jià)。
(2)設(shè)計(jì)3種不同的濃度��,覆蓋線性范圍的高�、中��、低濃度并考慮樣品的濃度范圍����,每種濃度分別制備至少3份供試品溶液進(jìn)行測定��。精密度的數(shù)據(jù)結(jié)果應(yīng)報(bào)告標(biāo)準(zhǔn)偏差�����、相對標(biāo)準(zhǔn)偏差或置信區(qū)間�。樣品中待測成分含量和精密度可接受范圍可參考表2���。在基質(zhì)復(fù)雜�����、組分含量低于0.01 %及多成分等分析中����,精密度限度可適當(dāng)放寬����。
表2 藥械組合醫(yī)療器械中藥物含量與精密度可接受范圍關(guān)系
待測成分含量 | 重復(fù)性(RSD�,%) |
1000 μg/mL | 3 |
100 μg/mL | 4 |
10 μg/mL | 6 |
1 μg/mL | 8 |
0.01 μg/mL | 15 |
4. 檢測限
檢測限系指樣品中被測物能被檢測出的最低量。檢測限僅作為定性鑒別的依據(jù)��,沒有定量意義�。常用的方法如下:
(1)直觀法
用已知濃度的被測物���,試驗(yàn)出能被可靠地檢測出的最低濃度或量。
(2)信噪比法
適用于能顯示基線噪音的分析方法�,即把已知低濃度試樣測出的信號與空白樣品測出的信號進(jìn)行比較���,確定出能被可靠地檢測出的被測物質(zhì)最低濃度或量��。一般以信噪比為3:1或2:1時(shí)相應(yīng)濃度確定為檢測限�。
(3)基于響應(yīng)值標(biāo)準(zhǔn)偏差和標(biāo)準(zhǔn)曲線斜率法
按照LOD=3.3δ/S公式計(jì)算�����,式中LOD為檢測限、δ為響應(yīng)值的偏差���、S為標(biāo)準(zhǔn)曲線的斜率。δ可以通過下列方法測得:①測定空白值的標(biāo)準(zhǔn)偏差��;②采用標(biāo)準(zhǔn)曲線的剩余標(biāo)準(zhǔn)偏差或是截距的標(biāo)準(zhǔn)偏差���。以上計(jì)算方法獲得的檢測限數(shù)據(jù)須用含量相近的樣品進(jìn)行驗(yàn)證。附測定圖譜�����,說明試驗(yàn)過程和檢測限結(jié)果�。
5. 定量限
定量限系指試樣中被測物能被定量測定的最低量,其測定結(jié)果應(yīng)符合準(zhǔn)確度和精密度的要求��。藥物含量測定方法���,應(yīng)確定方法的定量限。常用的方法如下:
(1)直觀法
用已知濃度的被測物���,試驗(yàn)出能被可靠地定量測定的最低濃度和量。
(2)信噪比法
適用于能顯示基線噪音的分析方法��,即將已知低濃度試樣測出的信號與空白樣品測出的信號進(jìn)行比較�,確定出能被可靠地定量的被測物質(zhì)的最低濃度或量���,一般以信噪比為10:1時(shí)相應(yīng)濃度確定為定量限。
(3)基于響應(yīng)值標(biāo)準(zhǔn)偏差和標(biāo)準(zhǔn)曲線斜率法
按照LOQ=10δ/S公式計(jì)算����,式中LOQ為定量限��、δ為響應(yīng)值的偏差�����、S為標(biāo)準(zhǔn)曲線的斜率�。δ可以通過下列方法測得:①測定空白值的標(biāo)準(zhǔn)偏差;②采用標(biāo)準(zhǔn)曲線的剩余標(biāo)準(zhǔn)偏差或是截距的標(biāo)準(zhǔn)偏差����。以上計(jì)算方法獲得的定量數(shù)據(jù)須用含量相近的樣品進(jìn)行驗(yàn)證����。附測定圖譜����,說明試驗(yàn)過程和定量結(jié)果���,包括準(zhǔn)確度和精密度驗(yàn)證數(shù)據(jù)����。
6. 線性
線性系指在設(shè)計(jì)的范圍內(nèi)�����,線性試驗(yàn)結(jié)果與試驗(yàn)中被測物濃度直接呈比例關(guān)系的程度�,是含量測定的基礎(chǔ)����。線性試驗(yàn)應(yīng)至少包含5個(gè)不同濃度水平。以測得的響應(yīng)信號與被測物濃度/含量作圖����,觀察是否呈線性�����,再用最小二乘法進(jìn)行線性回歸����。必要時(shí),響應(yīng)信號可經(jīng)數(shù)學(xué)轉(zhuǎn)換后進(jìn)行線性回歸計(jì)算�����,或采用描述濃度/含量-響應(yīng)關(guān)系的非線性模型�。線性數(shù)據(jù)應(yīng)至少列出回歸方程���、相關(guān)系數(shù)�����、線性圖(或其他數(shù)學(xué)模型)���。
7. 范圍
范圍系指分析方法能達(dá)到精密度����、準(zhǔn)確度和線性要求時(shí)的高低限濃度或量的區(qū)間。范圍根據(jù)分析方法的具體應(yīng)用及其線性�、準(zhǔn)確度、精密度結(jié)果和要求確定�。
選擇的方法應(yīng)保證待測藥物濃度在其線性范圍內(nèi)�,必要時(shí)可對浸提液進(jìn)行稀釋或濃縮���。
8. 耐用性
耐用性系指在測定條件有小的變動時(shí),測定結(jié)果不受影響的承受程度��。如果測試條件要求苛刻�,則應(yīng)在方法中寫明,并注明可以接受變動的范圍����。
9. 系統(tǒng)適用性
適用時(shí)�,還應(yīng)進(jìn)行系統(tǒng)適用性考察�����。如高效液相色譜法的適用性試驗(yàn)通常包括理論塔板數(shù)��、分離度�、靈敏度��、拖尾因子�、重復(fù)性等。
四�����、報(bào)告內(nèi)容
研究報(bào)告一般包括試驗(yàn)論述����、試驗(yàn)方案、試驗(yàn)報(bào)告���。其中,試驗(yàn)論述應(yīng)說明產(chǎn)品基本信息(材料組成�、人體接觸途徑及接觸時(shí)間等)及藥物基本信息、試驗(yàn)樣品選擇依據(jù)��;浸提條件描述及其選擇依據(jù)(如適用)�����;測定方法來源�����、適用性論述或測定方法驗(yàn)證報(bào)告��。試驗(yàn)方案應(yīng)包括浸提液制備(如適用)及測試方法、數(shù)據(jù)分析方案���。試驗(yàn)報(bào)告應(yīng)報(bào)告詳細(xì)的測試方法(包括設(shè)備及試劑來源、樣品制備步驟�����,必要時(shí)附圖)�、測試結(jié)果、數(shù)據(jù)處理���、結(jié)論及典型性圖譜等����。
五�����、參考文獻(xiàn)
[1]國家藥監(jiān)局關(guān)于藥械組合產(chǎn)品注冊有關(guān)事宜的通(國家藥品監(jiān)督管理局通告2021年第52號)[Z].2021.
[2]《冠狀動脈藥物洗脫支架臨床前研究指導(dǎo)原則》(國家藥品監(jiān)督管理局通告2018年第21號)[Z].2018.
[3]《宮內(nèi)節(jié)育器注冊技術(shù)審查指導(dǎo)原則》(國家藥品監(jiān)督管理局通告2019年第25號)[Z].2019.
[4]GB/T 39381.1-2020《心血管植入物 血管藥械組合產(chǎn)品 第1部分:通用要求》[S].
[5]ISO/TR 12417-2:2017,Cardiovascular implants and extracorporeal systems - Vascular device-drug combination products - Part 2: Local regulatory information [S]
[6]ASTM F2394 - 07(2017) Standard Guide for Measuring Securement of Balloon Expandable Vascular Stent Mounted on Delivery System [S]
[7]《中國藥典》2020版 四部(國家藥典委員會)
[8]《醫(yī)療器械已知可瀝濾物測定方法驗(yàn)證及確認(rèn)注冊技術(shù)審查指導(dǎo)原則》(國家藥品監(jiān)督管理局通告2019年第78號)[Z].2019.
[9]Guidelines for Single Laboratory Validation of Chemical Methods for Dietary Supplements and Botanicals(AOAC)
[10]Validation of Analytical Procedures:Text and Methodology Q2(ICH Harmonised Tripartite Guideline)
[11] GB/T 27417-2017《合格評定 化學(xué)分析方法確認(rèn)和驗(yàn)證指南》[S].
六、起草單位
國家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評中心
標(biāo)簽:藥械組合產(chǎn)品注冊