子宮輸卵管造影球囊導管通常由導管、連接件����、保護套管組成�。一般由高分子材料制成����。無菌提供。用于將造影劑注入子宮腔和輸卵管���,進行子宮輸卵管造影����。在我國屬于第二類醫(yī)療器械注冊產(chǎn)品���,一起來了解子宮輸卵管造影球囊導管注冊要求�����。
子宮輸卵管造影球囊導管通常由導管�����、連接件��、保護套管組成�����。一般由高分子材料制成�。無菌提供。用于將造影劑注入子宮腔和輸卵管���,進行子宮輸卵管造影��。在我國屬于第二類醫(yī)療器械注冊產(chǎn)品��,一起來了解子宮輸卵管造影球囊導管注冊要求�����。
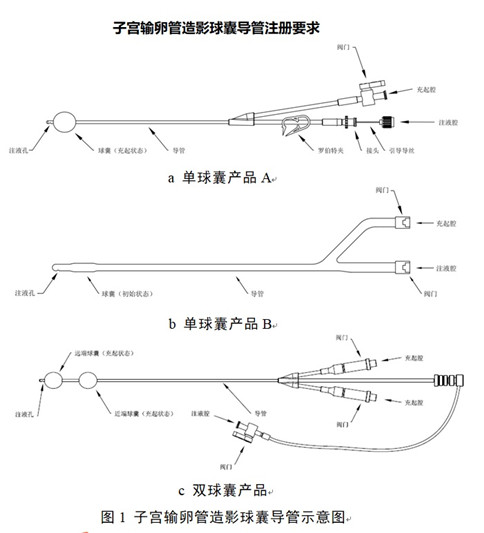
子宮輸卵管造影球囊導管注冊要求及審評要點:
1.產(chǎn)品結(jié)構(gòu)組成及工作原理
子宮輸卵管造影球囊導管通常由導管�、球囊����、閥門����、接頭等組成,可配有引導導絲�����、羅伯特夾、球囊充起組件作為配件���。導管包括充起腔和注液腔����,球囊為單球囊或雙球囊���。導管和球囊一般由高分子材料制成����,如硅橡膠���、乳膠�����、聚氯乙烯等��。產(chǎn)品以無菌形式提供��,一次性使用����。
將產(chǎn)品置入子宮腔,使產(chǎn)品的球囊位于子宮頸內(nèi)口的位置���,通過充起腔給球囊注液膨脹封堵住子宮頸�����,防止造影劑從子宮腔外泄��,再通過注液腔向子宮腔內(nèi)注入造影劑�����,使子宮腔和輸卵管顯影����,從而了解子宮腔和輸卵管內(nèi)情況����。
2.產(chǎn)品技術(shù)要求
根據(jù)《醫(yī)療器械注冊與備案管理辦法》的要求�,產(chǎn)品技術(shù)要求應(yīng)符合國家標準、行業(yè)標準和有關(guān)法律���、法規(guī)的要求��。在此基礎(chǔ)上����,申請人應(yīng)根據(jù)產(chǎn)品的特點制定保證產(chǎn)品安全有效、質(zhì)量可控的技術(shù)要求�����。產(chǎn)品技術(shù)要求及試驗方法均應(yīng)經(jīng)過驗證����。常見的技術(shù)指標包括但不限于:
2.1外觀與尺寸
2.1.1外觀
2.1.2尺寸
2.2物理性能
2.2.1強度
2.2.2球囊可靠性
2.2.3球囊回縮性能/液體回收率
2.2.4耐彎曲性
2.2.6閥門(如適用)的可靠性
2.2.7接頭(如適用)的要求
2.2.8若含有其他配件,應(yīng)制定相應(yīng)的性能指標���。如:含有球囊充起組件��,應(yīng)參考GB 15810中適用部分制定相應(yīng)性能指標�����。
2.3化學性能
2.4無菌
2.5環(huán)氧乙烷殘留(如適用)
3.化學和物理性能研究
應(yīng)當提供產(chǎn)品性能研究資料以及產(chǎn)品技術(shù)要求的研究和編制說明���,包括功能性�����、安全性指標(如化學性能�����、物理性能���、微生物性能)的確定依據(jù),所采用的標準或方法����、采用原因及理論基礎(chǔ)。
4.生物相容性評價研究
正常使用條件下子宮輸卵管造影球囊導管直接與人體接觸�����,應(yīng)參照GB/T 16886.1《醫(yī)療器械生物學評價 第1部分:風險管理過程中的評價與試驗》對子宮輸卵管造影球囊導管進行生物學評價��,至少進行體外細胞毒性��、刺激�����、皮膚致敏的生物學評價研究���。
生物相容性評價研究資料應(yīng)當包括:生物相容性評價的依據(jù)和方法��;產(chǎn)品所用材料的描述及與人體接觸的性質(zhì)���;實施或豁免生物學試驗的理由和論證;對于現(xiàn)有數(shù)據(jù)或試驗結(jié)果的評價�����。
5.滅菌工藝研究
提交產(chǎn)品滅菌方法的選擇依據(jù)及驗證報告���。器械的滅菌應(yīng)通過GB 18279.1��、GB/T 18279.2確認并進行常規(guī)控制�����,無菌保證水平(SAL)應(yīng)保證達到1×10-6�����。滅菌過程的選擇應(yīng)至少考慮以下因素:產(chǎn)品與滅菌過程的適應(yīng)性����;包裝材料與滅菌過程的適應(yīng)性;滅菌對產(chǎn)品安全有效性的影響�����。
若滅菌使用的方法易出現(xiàn)殘留����,應(yīng)明確殘留物的名稱、限量及其確定依據(jù)��、采取的處理措施及相應(yīng)的殘留量檢測報告����。
6.產(chǎn)品貨架有效期研究
產(chǎn)品貨架有效期是指產(chǎn)品在一定的溫度、濕度�、光線等條件的影響下保持其物理、化學�、生物學性質(zhì)的期限。有效期的研究應(yīng)貫穿于產(chǎn)品研究與開發(fā)的全過程�,在產(chǎn)品上市后還應(yīng)繼續(xù)進行有效期的研究。
貨架有效期包括產(chǎn)品有效期和包裝有效期����。產(chǎn)品有效期驗證可采用加速老化或?qū)崟r老化的研究���,應(yīng)遵循極限試驗等原則;加速老化研究試驗的具體要求可參考YY/T 0681.1��。
對于包裝的有效期驗證�����,建議申請人提交在選擇恰當?shù)牟牧虾桶b結(jié)構(gòu)合格后的最終成品包裝的初始完整性和維持完整性的檢測結(jié)果�。在進行加速老化試驗研究時應(yīng)注意產(chǎn)品選擇的環(huán)境條件的老化機制應(yīng)與在實時正常使用環(huán)境老化條件下真實發(fā)生產(chǎn)品老化的機制一致����。
7.包裝研究
產(chǎn)品包裝驗證可依據(jù)GB/T 19633、YY/T 0681系列標準等提交產(chǎn)品的包裝驗證報告�。包裝材料的選擇應(yīng)至少考慮以下因素:包裝材料的物理化學性能;包裝材料的毒理學特性�;包裝材料與產(chǎn)品的適應(yīng)性;包裝材料與成型和密封過程的適應(yīng)性�;包裝材料與滅菌過程的適應(yīng)性;包裝材料所能提供的物理�����、化學和微生物屏障保護;包裝材料與使用者使用時的要求(如無菌開啟)的適應(yīng)性����;包裝材料與標簽系統(tǒng)的適應(yīng)性;包裝材料與貯存運輸過程的適應(yīng)性�����。