醫(yī)療器械CE認(rèn)證 之 MDR指令的詳解
發(fā)布日期:2019-07-29 00:00瀏覽次數(shù):16938次
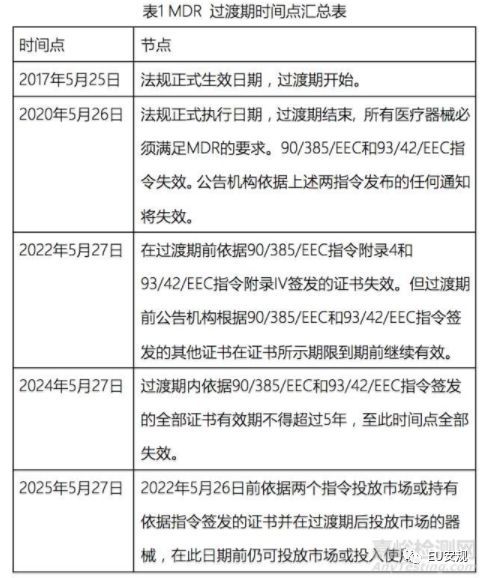
2017年5月5日在歐盟官方期刊上正式公布MDR醫(yī)療器械法規(guī)2017/745/EU用于取代舊MDD醫(yī)療指令93/42/EEC和AIMD有源植入性醫(yī)療器械指令90/385/EEC,并于2020年5月25號強(qiáng)制執(zhí)行(生效日期2017年5月26號����,過渡期三年)。
醫(yī)療器械CE認(rèn)證 - MDR指令的詳解
2017年5月5日在歐盟官方期刊上正式公布MDR醫(yī)療器械法規(guī)2017/745/EU用于取代舊MDD醫(yī)療指令93/42/EEC和AIMD有源植入性醫(yī)療器械指令90/385/EEC,并于2020年5月25號強(qiáng)制執(zhí)行(生效日期2017年5月26號���,過渡期三年)����。
注意原先的歐盟醫(yī)療器械監(jiān)管框架由醫(yī)療器械指令(MDD)93/42 / EEC和有源植入性醫(yī)療器械指令(AIMD)90/385 / EEC兩部分組成����。此次修訂把這兩個指令(MDD & AIMD)相結(jié)合,并作為法規(guī)而非指令來實(shí)施���。之所以選擇作為法規(guī)來實(shí)施���,是因?yàn)樗?guī)定了明確詳細(xì)的規(guī)則,不會對成員國的使用造成分歧���,并確保在整個歐盟同時間實(shí)施法律要求�����。
MDR醫(yī)療器械法規(guī)的目的是為醫(yī)療器械制定了高標(biāo)準(zhǔn)的質(zhì)量和安全標(biāo)準(zhǔn)��,以滿足這些產(chǎn)品的一般安全問題為患者和使用者提供高水平的健康保護(hù)����,同時確保醫(yī)療器械在歐盟單一市場內(nèi)的自由流通。
MDR不僅包含了MDD及AIMDD涵蓋的所有產(chǎn)品����;還覆蓋專門用于器械的清潔、消毒或滅菌的器械����,以及AnnexXVI列舉的無預(yù)期醫(yī)療目的的產(chǎn)品��,如美瞳���、面部填充或注射���、紋身、皮膚改善和美容等產(chǎn)品����。
1.包含某些藥械結(jié)合產(chǎn)品���,詳細(xì)請見Article1(8,9)����。
2.包含某些由非活性或處理為非活性的人類來源組織或細(xì)胞衍生物制造的特定產(chǎn)品。
3.包含聲稱僅具有美容目的或另一種非醫(yī)療目的�,但在功能和風(fēng)險特征方面類似于醫(yī)療器械的特定產(chǎn)品組
4.聲明納米材料器械屬于MDR范圍,且要接受最為嚴(yán)格的評估程序��。
5.包含發(fā)射離子輻射的器械和醫(yī)療用途的軟件�����。
MDD中與分類相關(guān)是93/42/EEC中的 Annex IX 和相應(yīng)的指南MEDDEV 2. 4/1 Rev. 9����;新的MDR中Article51和AnnexVIII 詳細(xì)闡述了產(chǎn)品的分類信息。主要變化是由MDD的“18條”�,改為MDR的“22條”。
Rule1-Rule 4: NON-INVASIVE DEVICES非侵入性器械
Rule3: 增加了用于體外直接從人體或人類胚胎取下體外使用的人體細(xì)胞�����、組織、氣管�,然后再植入或注入體內(nèi),此類器械為III類�����。
Rule 5-Rule 8:INVASIVE DEVICES侵入性器械
Rule 8:在原來的基礎(chǔ)上添加了:有源植入器械或其相關(guān)附件��,乳房植入物或心臟修補(bǔ)網(wǎng)狀織物�����,完整或部分關(guān)節(jié)置換物���,直接與脊柱接觸的椎間盤置換植入物為III類��。
Rule 9-Rule 13:ACTIVE DEVICES有源器械
Rule9:在原來的基礎(chǔ)上增加了“針對治療目的釋放電離輻射的有源器械”以及“用于控制、監(jiān)測或直接影響有源植入式器械”����,這兩大類器械均為II b類。
Rule11:新添加�����,提出用于提供診斷或治療目的決策信息和監(jiān)測生理過程的軟件,均為II a類�����;其他軟件類為I類��。
Rule 14-Rule 22:SPECIAL RULES特殊規(guī)則
Rule14:進(jìn)一步完善了“衍生自人體血液或血漿的醫(yī)療產(chǎn)品”分類的要求����。
Rule 18:進(jìn)一步完善“利用非活性或處理為非活性的人體或動物源組織或細(xì)胞或其他衍生物制成的器械”的分類要求。
Rule19:添加對納米材料器械的分類要求�����。
Rule20:添加了通過吸入方式�,與身體孔口相關(guān)的侵入器械的分類。
Rule 21:添加了引入人體可吸收物質(zhì)到人體的器械�。
Rule22: 添加了具有集成或合并診斷功能的有源治療器械的分類。
此外還刪除了MDD中對血袋的單獨(dú)分類�。
技術(shù)文件的要求
MDR中添加了對技術(shù)文件內(nèi)容的要求;且明確指出上市后監(jiān)管計劃和安全性更新報告(PSUR)都是技術(shù)文件的一部分���,并要求依據(jù)上市后監(jiān)管體系收集的資料對技術(shù)文件中相應(yīng)信息進(jìn)行更新���。
技術(shù)文件的基本內(nèi)容
1.器械說明與性能指標(biāo)
2.包括變型和附件包含器械說明與性能指標(biāo)����,以及引用的前代和類似器械的信息���。
3.制造商提供的信息
4.設(shè)計與制造信息
5.通用安全與性能要求
6.包含其符合附錄I提供的通用安全與性能要求的證明資料�。
7.風(fēng)險利益分析和風(fēng)險管理
8.產(chǎn)品驗(yàn)證與確認(rèn)
9.臨床前和臨床數(shù)據(jù)(包含臨床評價計劃/報告����,PMCF計劃/報告);以及針對含藥器械����、人體/動物來源組織或其衍生物制備的器械、引入人體并被吸收器械��、具有測量功能器械等的相關(guān)附加信息
加強(qiáng)器械上市后監(jiān)管體系
Chapter VIIPOST-MARKET SURVEILLANCE, VIGILANCE AND MARKET SURVEILLANCE 著重說明上市后監(jiān)管���、警戒和市場監(jiān)管�����。
1.建立、實(shí)施和維護(hù)上市后監(jiān)管體系(見Article83)�。
2.強(qiáng)調(diào)上市后監(jiān)管體系貫穿整個生命周期��,并不斷更新���。
3.建立“上市后監(jiān)管計劃”(見Article84),具體內(nèi)容見Annex III�。
4.I類器械編寫“上市后監(jiān)管報告”(見Article85)。
5.IIa����、IIb和III類器械編制“定期安全性更新報告(PSUR)”(見Article86)。
6.PSUR需定期更新并作為技術(shù)文件的一部分��。
7. 建立警戒和上市后監(jiān)管電子系統(tǒng)(見Article92)�����。
8. 在整個器械使用壽命期間���,依據(jù)實(shí)施PMCF后取得的臨床數(shù)據(jù)對臨床評價及技術(shù)文件進(jìn)行更新(Annex XIV part B)���。
sungomdr告訴您完善臨床評價相關(guān)要求
新法規(guī)提出:
1.要求根據(jù)Article61和附錄XIV partA執(zhí)行、評估��、報告和更新臨床評價資料�����;
2.提出對特定III類和IIb類器械,CER中要考慮咨詢專家小組的意見�����;
3.對植入和III類器械����,提出考慮臨床研究;
4.要求CER按照PMCF取得數(shù)據(jù)進(jìn)行更新�����;
5.針對III類和可植入器械���,提出了CER更新的頻率�����;
6.明確證明實(shí)質(zhì)等同性需考慮的特點(diǎn)�;
7.要求其與風(fēng)險管理的相互作用
提出器械的可追溯性(UDI)
1.除定制和研究器械外�����,其他器械均需建立UDI系統(tǒng)����;
2.UDI信息體現(xiàn)在標(biāo)簽或包裝上(不包含集裝箱);
3.UDI-DI信息需要載明于符合性聲明中(見Article27)�;
4.Annex VI Part B提出UDI-DI包含的信息;
5.可植入����、重復(fù)使用、軟件��、可配置器械的UDI有特殊要求(見Annex VI Part C)
6.包裝或標(biāo)簽上UDI實(shí)施的時間見Article123 (f)��。
7.UDI 發(fā)行實(shí)體由歐盟委員會指定�����。
8.過渡性:Article 120指出“在委員會根據(jù)第27(2)條指定發(fā)行實(shí)體前�,GS1、HIBCC和ICCBBA應(yīng)被視為指定的發(fā)行實(shí)體”��。
新的歐盟MDR認(rèn)證對NB提出的嚴(yán)格要求
對“公告機(jī)構(gòu)”���,新版MDR花費(fèi)大篇幅對其進(jìn)行職能和要求進(jìn)行描述��;各NB需按照附錄VII的要求重新申請MDR的三方審核的授權(quán)