歐盟一類(lèi)醫(yī)療器械CE認(rèn)證需要技術(shù)文件嗎
發(fā)布日期:2021-05-25 23:20瀏覽次數(shù):2548次
明天是2021年5月26日�,是歐盟醫(yī)療器械法規(guī)MDR EU 2017/745因新冠疫情推遲一年后正式實(shí)施的日期。對(duì)于一類(lèi)醫(yī)療器械�,很多客戶(hù)類(lèi)比成國(guó)內(nèi)備案,認(rèn)為非常簡(jiǎn)單��。從專(zhuān)業(yè)角度來(lái)看��,一類(lèi)醫(yī)療器械CE認(rèn)證?與國(guó)內(nèi)備案有先溝通之處�����,但也存在較大差異��。
引言:明天是2021年5月26日�����,是歐盟醫(yī)療器械法規(guī)MDR EU 2017/745因新冠疫情推遲一年后正式實(shí)施的日期�。對(duì)于一類(lèi)醫(yī)療器械,很多客戶(hù)類(lèi)比成國(guó)內(nèi)備案����,認(rèn)為非常簡(jiǎn)單。從專(zhuān)業(yè)角度來(lái)看��,一類(lèi)醫(yī)療器械CE認(rèn)證與國(guó)內(nèi)備案有先溝通之處,但也存在較大差異�����。
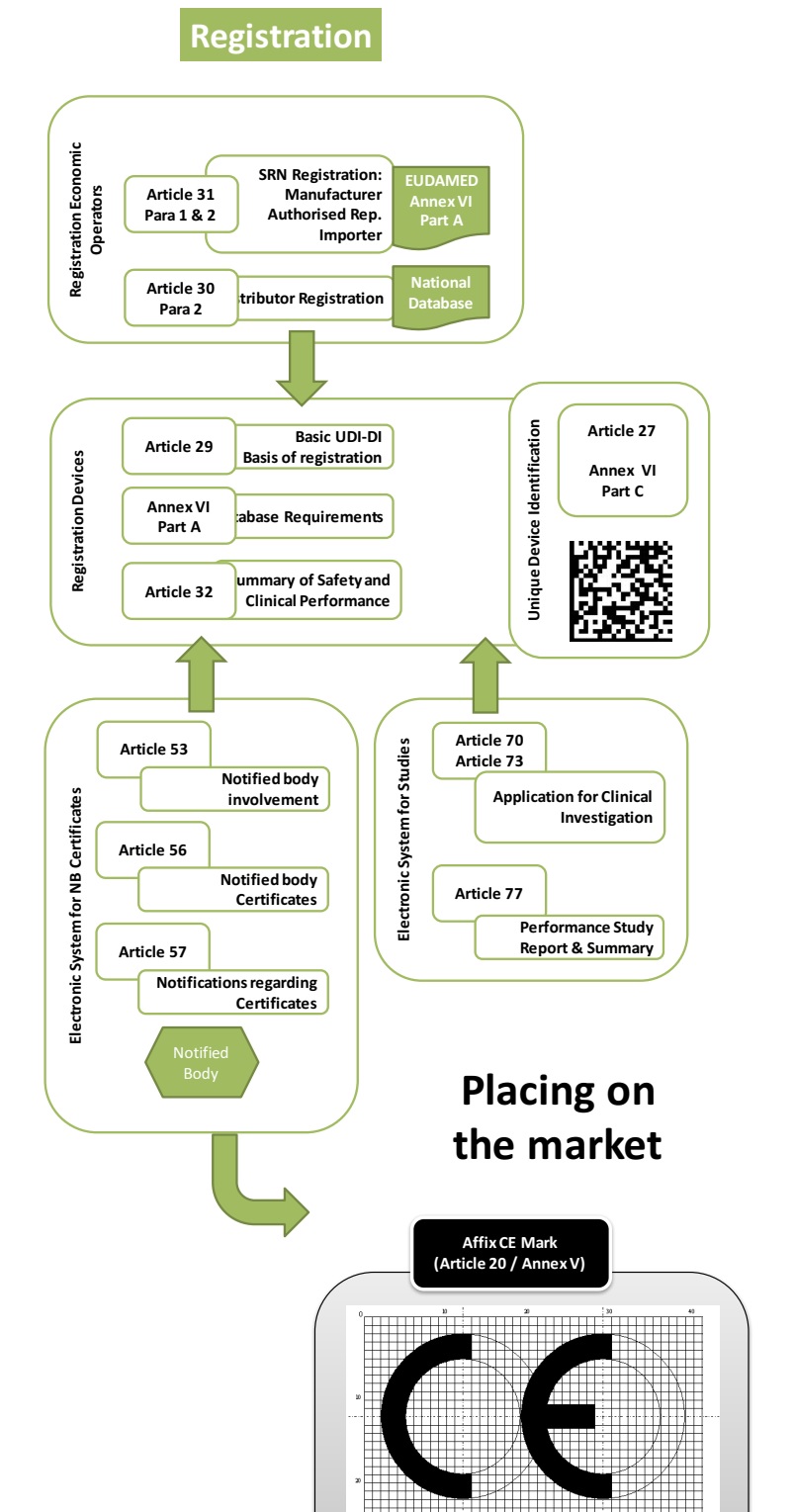
按照MDR的規(guī)定���,對(duì)于自我宣告類(lèi)器械,需要指定歐盟授權(quán)代表并完成器械注冊(cè)后���,才可以合法加貼CE標(biāo)志并上市銷(xiāo)售���。下圖是歐盟醫(yī)療器械注冊(cè)流程圖: