乙型肝炎病毒前S1抗原檢測試劑臨床試驗資料技術(shù)審評要點旨在指導(dǎo)注冊申請人對乙型肝炎病毒前S1抗原檢測試劑產(chǎn)品注冊臨床試驗的開展及臨床試驗資料的準備及撰寫,同時也為技術(shù)審評部門審評臨床試驗資料提供參考�����。
引言:乙型肝炎病毒前S1抗原檢測試劑臨床試驗資料技術(shù)審評要點旨在指導(dǎo)注冊申請人對乙型肝炎病毒前S1抗原檢測試劑產(chǎn)品注冊臨床試驗的開展及臨床試驗資料的準備及撰寫�����,同時也為技術(shù)審評部門審評臨床試驗資料提供參考��。
乙型肝炎病毒前S1抗原檢測試劑臨床試驗資料技術(shù)審評要點
本審評要點旨在指導(dǎo)注冊申請人對乙型肝炎病毒前S1抗原檢測試劑產(chǎn)品注冊臨床試驗的開展及臨床試驗資料的準備及撰寫����,同時也為技術(shù)審評部門審評臨床試驗資料提供參考����。
本審評要點是對乙型肝炎病毒前S1抗原檢測試劑產(chǎn)品臨床試驗資料的一般要求,注冊申請人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用���,若不適用�,需具體闡述理由及相應(yīng)的科學(xué)依據(jù),并依據(jù)產(chǎn)品的具體特性對臨床試驗資料的內(nèi)容進行充實和細化�����。
一��、適用范圍
本審評要點適用于乙型肝炎病毒前S1抗原檢測試劑產(chǎn)品注冊的臨床試驗的開展�����。
本審評要點所指乙型肝炎病毒前S1抗原檢測試劑是指用于體外定性檢測人血清或血漿樣本中乙型肝炎病毒前S1抗原的體外診斷試劑����。
乙型肝炎病毒(HBV)外膜蛋白由S蛋白、前S1蛋白和前S2蛋白共同構(gòu)成���。前S1蛋白由乙型肝炎病毒前S1基因編碼�,由108或119個氨基酸組成���,主要存在于完整的Dane顆粒����、管型顆粒表面,其作為HBV的外殼蛋白成分�,在HBV感染者血清中一般與乙型肝炎病毒表面抗原共同表達,在病毒的裝配�、復(fù)制和刺激機體產(chǎn)生免疫反應(yīng)方面具有十分重要的作用。乙型肝炎病毒前S1抗原(HBV PreS1-Ag)是病毒存在和復(fù)制的標志���。
適用方法學(xué)包括:化學(xué)發(fā)光法。
本審評要點適用于乙型肝炎病毒感染的輔助診斷預(yù)期用途���。
按現(xiàn)行《體外診斷試劑分類子目錄》���,該產(chǎn)品分類編碼為6840,管理類別為Ⅲ類����。
二、臨床研究
(一)臨床試驗機構(gòu)的選擇
選擇不少于3家具備相應(yīng)條件且按照規(guī)定備案的醫(yī)療器械臨床試驗機構(gòu)���。
(二)臨床試驗設(shè)計類型
選擇境內(nèi)已批準上市�、臨床普遍認為質(zhì)量較好的同類產(chǎn)品作為對比試劑�����,采用試驗體外診斷試劑與之進行對比試驗研究,證明本品與已上市產(chǎn)品一致�����。盡量選擇與試驗體外診斷試劑方法學(xué)具有可比性的產(chǎn)品����。
(三)對比方法的選擇
選擇與已上市同類產(chǎn)品進行比較研究。對比試劑的樣本類型應(yīng)涵蓋試驗體外診斷試劑的樣本類型��,檢測性能應(yīng)與試驗體外診斷試劑具有良好的可比性��。
(四)病例入排標準
選擇需要進行相應(yīng)檢查的受試人群�����,主要包括疑似乙肝患者的人群�����。
(五)入組病例數(shù)要求
建議采用單組目標值法進行最低樣本量的估算�����。通過陽性符合率和陰性符合率來分別計算所需陽性樣本和陰性樣本的例數(shù)。陰�、陽性符合率的臨床可接受標準(P0)建議不低于95%。
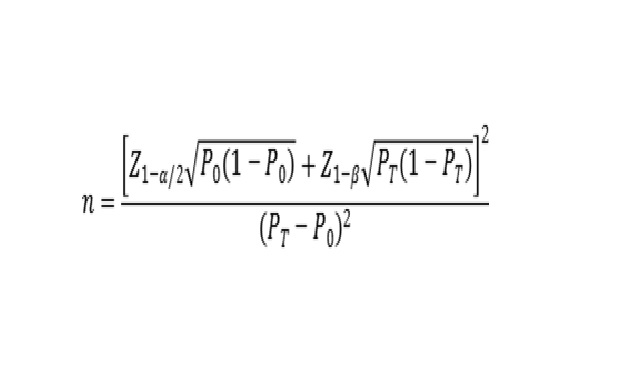
公式中��,n為樣本量���;Z1-α/2�����、Z1-β為顯著性水平和把握度的標準正態(tài)分布的分數(shù)位,P0為評價指標的臨床可接受標準�,PT為申報產(chǎn)品評價指標預(yù)期值。
對于血清和血漿樣本如臨床前研究證明兩者的性能無差異���,臨床試驗中可匯總統(tǒng)計��。
(六)臨床評價指標和統(tǒng)計學(xué)分析
一般選擇四格表的形式總結(jié)兩種試劑/方法的定性檢測結(jié)果����,計算陽性符合率����、陰性符合率、總符合率及其95%置信區(qū)間,以及Kappa值��。
其中陽性符合率及陰性符合率95%置信區(qū)間下限均應(yīng)不低于95%���。
本要點僅針對乙型肝炎病毒前S1抗原檢測試劑臨床試驗中重點關(guān)注的內(nèi)容�����,其他內(nèi)容應(yīng)遵循體外診斷試劑相關(guān)法規(guī)�����、文件的要求���。