依據(jù)醫(yī)療器械分類目錄��,一次性使用靜脈營養(yǎng)輸液袋在我國屬于第三類醫(yī)療器械注冊產(chǎn)品��,分類編碼14-02-11�����,一起來學習一次性使用靜脈營養(yǎng)輸液袋注冊流程和審查要點�。
引言:依據(jù)醫(yī)療器械分類目錄,一次性使用靜脈營養(yǎng)輸液袋在我國屬于第三類醫(yī)療器械注冊產(chǎn)品���,分類編碼14-02-11���,一起來學習一次性使用靜脈營養(yǎng)輸液袋注冊流程和審查要點。
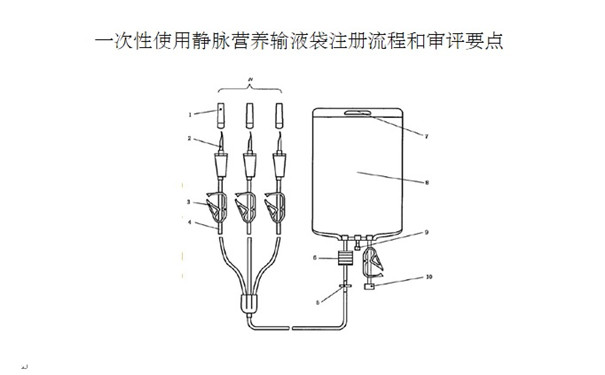
一��、醫(yī)療器械注冊單元劃分
產(chǎn)品的注冊單元劃分原則上應(yīng)符合《醫(yī)療器械注冊單元劃分指導原則》的要求����,主要材質(zhì)不同的靜脈營養(yǎng)袋建議劃分為不同的注冊單元進行申報。
對于產(chǎn)品的型號規(guī)格劃分����,應(yīng)說明產(chǎn)品的型號規(guī)格及劃分依據(jù),明確各型號規(guī)格的區(qū)別(如公稱容量的不同��,是否含進氣器件、注射件�����、瓶塞穿刺器等)���,可列表對不同型號規(guī)格的結(jié)構(gòu)組成加以描述,也可采用示意圖進行表述�。
二、一次性使用靜脈營養(yǎng)輸液袋產(chǎn)品技術(shù)要求
醫(yī)療器械注冊申請人應(yīng)結(jié)合產(chǎn)品的技術(shù)特征和臨床使用情況來編制技術(shù)要求�,對宣稱的技術(shù)參數(shù)和功能,若適宜�����,應(yīng)在產(chǎn)品技術(shù)要求中予以規(guī)定���;產(chǎn)品技術(shù)要求中的內(nèi)容引用國家標準���、行業(yè)標準的應(yīng)保證其適用性。
產(chǎn)品技術(shù)要求應(yīng)包括但不局限于以下內(nèi)容:
2.1產(chǎn)品型號規(guī)格及劃分說明
應(yīng)列明申報型號規(guī)格及其劃分依據(jù)��,明確各型號規(guī)格的區(qū)別���,可列表對不同型號規(guī)格的結(jié)構(gòu)組成加以描述��。
2.2產(chǎn)品的基本信息
2.2.1產(chǎn)品各組件及對應(yīng)原材料的列表����;與人體直接或間接接觸的組件需明確原材料牌號或符合的醫(yī)用級國行標。
2.2.2產(chǎn)品結(jié)構(gòu)示意圖��。
2.2.3產(chǎn)品滅菌方式�、有效期等。
2.3性能要求及試驗方法
2.3.1物理性能
應(yīng)包含YY/T 0611《一次性使用靜脈營養(yǎng)輸液袋》適用的相關(guān)性能���,申報產(chǎn)品的結(jié)構(gòu)非YY/T 0611的設(shè)計結(jié)構(gòu)���,或在YY/T 0611給出的結(jié)構(gòu)基礎(chǔ)上還有其它設(shè)計元素的,應(yīng)制訂與之相關(guān)的性能要求��,如進液管路上裝配的藥液過濾器等���。
2.3.2化學性能
應(yīng)包含YY/T 0611適用的化學要求�。
2.3.3 其他
無菌����、細菌內(nèi)毒素����。
產(chǎn)品性能指標和試驗方法若不適用于YY/T 0611的相關(guān)要求����,需具體闡述其理由及相應(yīng)的科學依據(jù)。性能要求的試驗方法采用注冊申請人自行制定方法的�����,應(yīng)在研究資料中補充方法學驗證報告����。
三���、適用范圍和禁忌證
3.1適用范圍:用于醫(yī)療機構(gòu)中���,使用前充入營養(yǎng)液或藥液,再與輸液器和靜脈內(nèi)器械(如中心靜脈導管)連接向體內(nèi)輸注���。申報產(chǎn)品如含分離式輸液管路�����,應(yīng)注明申報產(chǎn)品是采用壓力輸注還是重力輸注�。
3.2禁忌證:說明該器械不適用的人群或情形。
四��、一次性使用靜脈營養(yǎng)輸液袋注冊流程
按照我國第三類醫(yī)療器械注冊流程辦理即可�。
更多有關(guān)第三類醫(yī)療器械注冊服務(wù)需求,歡迎您隨時方便與杭州證標客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò)�����,聯(lián)系人:葉工�����,電話:18058734169���,微信同��。