腹腔內(nèi)窺鏡手術(shù)系統(tǒng)技術(shù)審評要點(2023年修訂版)旨在指導(dǎo)醫(yī)療注冊申請人對腹腔內(nèi)窺鏡手術(shù)系統(tǒng)產(chǎn)品注冊申報資料的準備及撰寫����,同時也為技術(shù)審評部門審評注冊申報資料提供參考。
腹腔內(nèi)窺鏡手術(shù)系統(tǒng)技術(shù)審評要點(2023年修訂版)
本審評要點旨在指導(dǎo)注冊申請人對腹腔內(nèi)窺鏡手術(shù)系統(tǒng)產(chǎn)品注冊申報資料的準備及撰寫�����,同時也為技術(shù)審評部門審評注冊申報資料提供參考����。
本審評要點是對腹腔內(nèi)窺鏡手術(shù)系統(tǒng)產(chǎn)品的一般要求����,注冊申請人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用����,若不適用,需具體闡述理由及相應(yīng)的科學(xué)依據(jù)����,并依據(jù)產(chǎn)品的具體特性對注冊申報資料的內(nèi)容進行充實和細化。
一����、產(chǎn)品范圍
本審評要點適用于多孔腹腔內(nèi)窺鏡手術(shù)系統(tǒng)(簡稱手術(shù)系統(tǒng)),按現(xiàn)行《醫(yī)療器械分類目錄》�,該類產(chǎn)品分類編碼為01-07-03,管理類別為Ⅲ類����。
二、產(chǎn)品簡介
腹腔內(nèi)窺鏡手術(shù)系統(tǒng)產(chǎn)品組成通常包括醫(yī)生控制臺�、患者手術(shù)平臺、影像處理平臺���、三維腹腔內(nèi)窺鏡(簡稱內(nèi)窺鏡)��、手術(shù)器械等�。
(一)醫(yī)生控制臺
外科醫(yī)生位于醫(yī)生控制臺,通過使用手動控制器(主控制器)和一組腳踏板(如有)來控制手術(shù)器械和內(nèi)窺鏡(如有)的所有運動�����。內(nèi)窺鏡用于采集手術(shù)區(qū)域的立體圖像���,外科醫(yī)生在3D觀察器(圖1)或者佩戴3D眼鏡在顯示屏(圖2)上觀察患者解剖和手術(shù)器械的視圖及其他用戶界面特征。本文圖示僅為示例��,實際不同廠家結(jié)構(gòu)設(shè)計有所不同�。
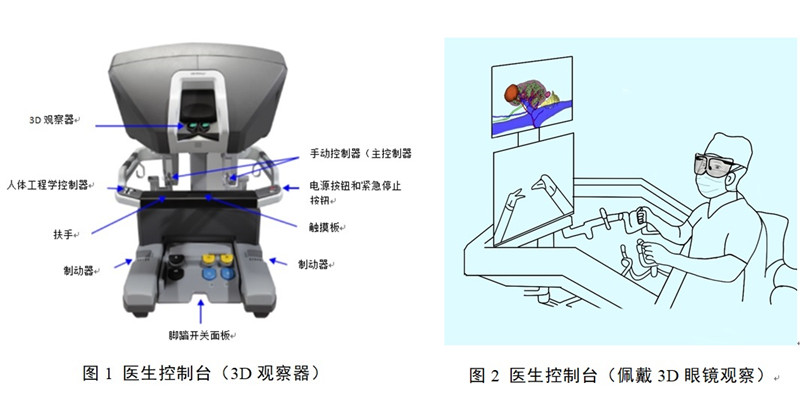
醫(yī)生控制臺最主要的控制部件為手動控制器,如圖3所示���。手動控制器用以捕捉外科醫(yī)生的手部或者手臂動作�,例如手動控制器平移6cm��,終端器械移動的距離為2cm����,該比例可根據(jù)實際手術(shù)情況進行調(diào)節(jié)(如有)�����。

(二)患者手術(shù)平臺
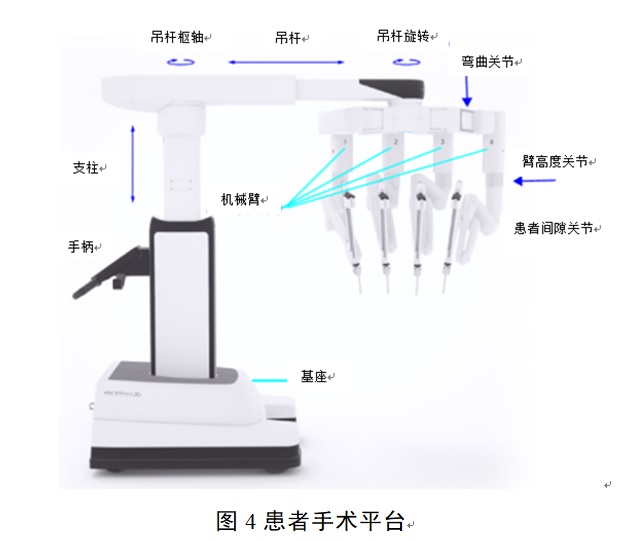
患者手術(shù)平臺位于手術(shù)床旁�����,包含分體或單體的多個機械臂���,機械臂上可以連接內(nèi)窺鏡(如有)和手術(shù)器械。內(nèi)窺鏡用于提供患者解剖結(jié)構(gòu)的3D視圖��。手術(shù)器械由醫(yī)生通過醫(yī)生控制臺進行控制�����,實現(xiàn)手術(shù)操作����。不同廠家患者手術(shù)平臺的結(jié)構(gòu)、設(shè)計和各部分的叫法可能有所差異����,但基本原理和功能類似。
1. 激光定位
患者手術(shù)平臺可具有激光指示燈,為用戶提供定位信息��。手術(shù)前首先進行水平定位和手術(shù)定位���,使手術(shù)平臺和機械臂處于一個合適的手術(shù)位置����。
2. 吊桿
吊桿是可調(diào)節(jié)的旋轉(zhuǎn)支撐結(jié)構(gòu)����,可以將機械臂移動到適合于執(zhí)行手術(shù)的位置。
3. 立柱
可向上或向下移動吊桿以調(diào)整平臺的高度��。
4. 機械臂
根據(jù)產(chǎn)品設(shè)計不同�,機械臂數(shù)量可能不同�����。機械臂的作用是實現(xiàn)握持并移動或操控內(nèi)窺鏡(如有)和手術(shù)器械���。機械臂通過器械中多個轉(zhuǎn)輪對器械進行控制���。每個轉(zhuǎn)輪負責控制不同的器械動作,比如有的控制繞軸線自轉(zhuǎn)�、有的控制開合等��。
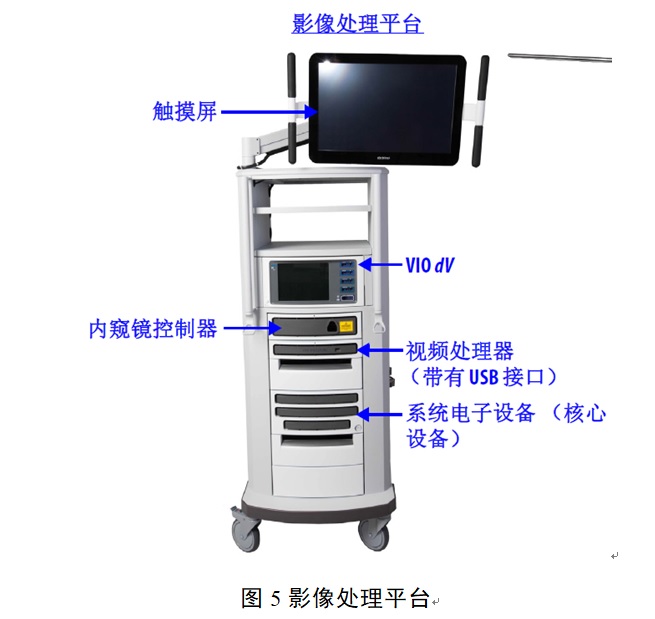
(三)影像處理平臺(如有)
影像處理平臺包括系統(tǒng)核心設(shè)備�����、內(nèi)窺鏡控制器和視頻處理器����。影像處理平臺還可具有觸摸屏以觀看內(nèi)窺鏡圖像并調(diào)整系統(tǒng)設(shè)置��。內(nèi)窺鏡控制器用于為內(nèi)窺鏡提供控制和照明����,視頻處理器用于從內(nèi)窺鏡控制器獲取左右視頻輸入信號,并將處理后的圖像輸出提供給核心設(shè)備��,系統(tǒng)核心設(shè)備功能包括:
1.與醫(yī)生控制臺及患者手術(shù)平臺進行通信���。將來自各種源(例如視頻處理器��、外部輸入)的視頻信號分發(fā)到各種終端(例如觸摸屏����、外部輸出);
2.與能量平臺通信�,從醫(yī)生控制臺腳踏板啟用能量實現(xiàn)電凝、電灼��、電切�、吻合、血管閉合等功能��。
影像處理平臺組成如圖5所示���。
手術(shù)系統(tǒng)如使用通用的三維腹腔內(nèi)窺鏡(非手術(shù)系統(tǒng)專用)提供影像�����,產(chǎn)品組成可不包括影像處理平臺�。
以上是典型的腹腔內(nèi)窺鏡手術(shù)系統(tǒng)的工作原理��,描述僅為舉例����,注冊申報資料按產(chǎn)品實際情況描述���,產(chǎn)品組成可在上述基礎(chǔ)上有所增減���,例如不包括內(nèi)窺鏡以及影像處理平臺����,不包含激光定位裝置等����。
腹腔內(nèi)窺鏡手術(shù)系統(tǒng)核心的工作原理是“主從遙操作”,即操作者操控醫(yī)生控制臺上的主控制器�,經(jīng)傳感器測量、主從映射變化���、從手逆運動學(xué)等機器人學(xué)原理�,計算從手各關(guān)節(jié)的位置和速度�����,以實現(xiàn)對主手運動的精確復(fù)制�,從而精確控制患者手術(shù)平臺上的手術(shù)器械并完成手術(shù)。
三��、參考文件
(一)適用和可參考的指導(dǎo)原則
見附件1�����。
(二)適用和可參考的標準
見附件2。
四�����、審評主要關(guān)注點
在參照相關(guān)法規(guī)�、規(guī)章、指導(dǎo)原則���、標準的情況前提下���,結(jié)合下列關(guān)注點開展技術(shù)審評。
(一)綜述資料
按照《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告》(國家藥監(jiān)局2021年第121號)提交申報資料��,在綜述資料中提供產(chǎn)品組成各部分的清晰的彩色實物圖示�����,包括醫(yī)生控制臺的各細節(jié)�����、患者手術(shù)平臺的各細節(jié)�����、手術(shù)器械末端����、手術(shù)連接部、機械臂����、按鍵、接口等��,說明各個組成部分的作用以及連接關(guān)系��,包括腳踏面板上各部分的作用����,多個機械臂如有差異的應(yīng)予以說明。說明各運動部分的自由度并以配以圖示��。如配合使用的產(chǎn)品已獲得注冊證或正在進行注冊�,應(yīng)提供相應(yīng)注冊證或說明注冊進度,例如超聲軟組織手術(shù)刀頭配用的超聲軟組織手術(shù)設(shè)備��。對于專用第三方設(shè)備��,應(yīng)提供雙方的合作協(xié)議����。
列表比較與參考的同類產(chǎn)品的異同����,應(yīng)包括在主控制臂�、運動控制、機械臂結(jié)構(gòu)����、手術(shù)器械等方面的差異。
(二)非臨床資料
1.產(chǎn)品風(fēng)險管理資料
按照121號公告提交��,重點關(guān)注以下風(fēng)險:
(1)運動不受控:操作不當����、軟件故障、機械臂碰撞等導(dǎo)致�����,造成患者意外傷害�。
(2)感染風(fēng)險:手術(shù)器械未按要求進行再處理。
(3)手術(shù)器械超期使用:應(yīng)按照已驗證的次數(shù)使用����,超期性能下降會導(dǎo)致手術(shù)風(fēng)險�����。
2.產(chǎn)品技術(shù)要求及檢驗報告
產(chǎn)品技術(shù)要求可參考的標準見附件2,格式及內(nèi)容見附件3��。產(chǎn)品含有多個軟件組件的�,應(yīng)列出所有軟件組件的名稱、發(fā)布版本及命名規(guī)則�����。涉及運動范圍的�,建議給出運動范圍圖示。對于三維內(nèi)窺鏡����,產(chǎn)品技術(shù)要求中應(yīng)包括左右兩路有效光度率偏差、左右兩路單位相對畸變偏差���、左右兩路圖像旋轉(zhuǎn)偏差�、左右兩路中心位置偏差(水平方向和垂直方向)�、左右兩路放大倍率差、左右兩路圖像時差(電子鏡適用)的要求�����。
3.研究資料
3.1化學(xué)和物理性能研究
3.1.1 應(yīng)當提供產(chǎn)品化學(xué)/材料表征、物理和/或機械性能指標的確定依據(jù)�、設(shè)計輸入來源以及臨床意義,所采用的標準或方法��、采用的原因及理論基礎(chǔ)�����。 提供產(chǎn)品機械臂搭載手術(shù)器械后的控制精度的相關(guān)技術(shù)資料�����,以及各級傳遞后的理論累計誤差��;基于上述因素�����,確認產(chǎn)品當前所確定的主從控制精度是否合理且可接受�。提供運動控制重復(fù)性、復(fù)現(xiàn)性等驗證資料�。重復(fù)性應(yīng)考慮模擬產(chǎn)品在最不利情形下主從操作重復(fù)性的研究。復(fù)現(xiàn)性應(yīng)考慮不同的手術(shù)環(huán)境、不同手術(shù)操作者�����、不同術(shù)式��、不同入路深度�����、不同速度下運動控制精度的一致性�����。提供主從映射下的器械末端運動平滑度研究��,提供在典型手術(shù)操作軌跡下運動時的器械末端的速度�����、加速度以及末端振顫���。申請人應(yīng)闡述所選取的典型手術(shù)操作的確定依據(jù)。提供機械臂的穩(wěn)定性研究�,模擬各種非正常狀態(tài)(如誤操作、外界碰撞等)對設(shè)備穩(wěn)定性的影響,評估是否會發(fā)生不可接受的風(fēng)險���;提供手術(shù)器械與組織接觸力的研究���;提供各種最不利情形下的延遲(機械延遲、視覺延遲)和運動范圍研究��。最不利的情形包括模擬臨床各種典型術(shù)式下���,不同入路����、不同擺位以及極端工作條件等�。申請人應(yīng)闡述最不利情形的確定依據(jù)。
3.1.2 聯(lián)合使用
含有超聲刀頭�����、血管閉合器的��,應(yīng)提供其與聲稱的主機聯(lián)合使用研究資料�����。
3.2電氣系統(tǒng)安全性研究
應(yīng)當提供電氣安全性、機械和環(huán)境保護以及電磁兼容性的研究資料�����,說明適用的標準以及開展的研究��。
3.3輻射安全研究
產(chǎn)品組成中如含有光源�,應(yīng)提供光輻射安全研究資料?�?蓞⒖肌夺t(yī)療器械光輻射安全注冊審查指導(dǎo)原則》提交資料��。
3.4軟件研究
手術(shù)系統(tǒng)軟件安全性級別通常為嚴重�����。申請人應(yīng)按照《醫(yī)療器械軟件注冊技術(shù)審查指導(dǎo)原則》的相關(guān)要求提供資料����。如涉及網(wǎng)絡(luò)安全(例如具備電子數(shù)據(jù)交換��、遠程訪問與控制�、用戶訪問),應(yīng)按照《醫(yī)療器械網(wǎng)絡(luò)安全注冊技術(shù)審查指導(dǎo)原則》相關(guān)要求提供資料��。產(chǎn)品若通過電子接口與其他醫(yī)療器械或非醫(yī)療器械交換并使用信息,應(yīng)當提供互操作性研究資料����,包括基本信息、需求規(guī)范�、風(fēng)險管理、驗證與確認�、維護計劃等內(nèi)容。
3.5生物學(xué)特性研究
手術(shù)系統(tǒng)中內(nèi)窺鏡���、手術(shù)器械���、3D觀察器等與人體(患者、操作者等)直接或間接接觸的部分�����,應(yīng)進行生物學(xué)特性研究��。
(1)描述產(chǎn)品所用材料及與人體接觸性質(zhì)���,設(shè)計和生產(chǎn)過程中可能引入的污染物和殘留物�����,設(shè)計和生產(chǎn)過程中可能產(chǎn)生的析出物(包括濾瀝物和/或蒸發(fā)物)�、降解產(chǎn)物、加工殘留物��,與醫(yī)療器械直接接觸的包裝材料等相關(guān)信息��。
(2)描述申報產(chǎn)品的物理和/或化學(xué)信息并考慮材料表征(如適用)����,如器械的物理作用可能產(chǎn)生生物學(xué)風(fēng)險,應(yīng)當進行評價�����。
(3)生物學(xué)評價的策略��、依據(jù)和方法���。
(4)已有數(shù)據(jù)和結(jié)果的評價。
(5)選擇或豁免生物學(xué)試驗的理由和論證����。
(6)完成生物學(xué)評價所需的其他數(shù)據(jù)。
如含有多種手術(shù)器械且原材料�、滅菌方式����、加工工藝�����、預(yù)期用途等存在差異的�����,應(yīng)對每種手術(shù)器械分別開展生物學(xué)評價�。生物學(xué)特性研究應(yīng)描述每個接觸部位所用的材料,以圖示進行說明���,如涉及開展生物學(xué)試驗的���,通常應(yīng)考慮開展細胞毒性、致敏�����、皮內(nèi)反應(yīng)��、材料介導(dǎo)的致熱性(如適用)����、急性全身毒性(如適用)試驗�����,可選取典型產(chǎn)品進行試驗���,并說明評價產(chǎn)品與試驗產(chǎn)品之間的差異。如手術(shù)器械的成分僅為醫(yī)用不銹鋼�����,不包含鍍層或者金屬合金��,無加工助劑或者滅菌劑殘留的����,申請人如提供了材質(zhì)證明,可豁免生物相容性試驗�����。具有可浸提物/可瀝濾物的手術(shù)器械及其附件��,應(yīng)考慮致熱性和急性全身毒性的要求���。與已上市產(chǎn)品相比���,如內(nèi)窺鏡或手術(shù)器械中采用新的材料,申請人應(yīng)在評價資料中詳述其理化性能和生物學(xué)特性��。如豁免生物學(xué)試驗����,可參考《關(guān)于印發(fā)醫(yī)療器械生物學(xué)評價和審查指南的通知》(國食藥監(jiān)械﹝2007﹞345號)中的附件2出具評價報告。
3.6清潔�����、消毒�����、滅菌研究
手術(shù)系統(tǒng)中的內(nèi)窺鏡以及手術(shù)器械在使用過程中與人體無菌組織接觸���,使用前均應(yīng)進行滅菌��。申請人應(yīng)開展清潔���、消毒�、滅菌研究����。
(1)生產(chǎn)企業(yè)滅菌:應(yīng)當明確滅菌工藝(方法和參數(shù))和無菌保證水平(SAL),并提供滅菌驗證及確認的相關(guān)研究資料����。
(2)使用者滅菌:應(yīng)當明確推薦的滅菌工藝(方法和參數(shù))、所推薦滅菌工藝的確定依據(jù)以及驗證的相關(guān)研究資料�;對可耐受兩次或多次滅菌的產(chǎn)品,應(yīng)當提供產(chǎn)品所推薦滅菌工藝耐受性的研究資料��,證明產(chǎn)品按照正常滅菌耐受次數(shù)進行清洗����、消毒、滅菌和使用后�����,產(chǎn)品性能功能符合預(yù)期要求�。申請人進行滅菌確認時應(yīng)考慮經(jīng)確認的滅菌程序適用于使用者,包括滅菌工藝�����、滅菌設(shè)備���、滅菌包裝等�?��?蓞⒖济绹鳩DA指南Reprocessing Medical Device in Health Care Settings:Validation Methods and Lableling�����。
滅菌確認報告應(yīng)能證明所推薦的滅菌工藝對于申報產(chǎn)品的滅菌效果�,所有器械應(yīng)接受最惡劣的微生物挑戰(zhàn)和滅菌挑戰(zhàn)��,并在滅菌后進行無菌測試�。若申請人經(jīng)過評價認為申報產(chǎn)品適用于其他已確認產(chǎn)品的滅菌程序,可提供相關(guān)的評價資料和其他產(chǎn)品的滅菌確認報告����,評價資料應(yīng)對與滅菌有效性相關(guān)的特征逐一進行評價,包括生物負載��、包裝�����、結(jié)構(gòu)(開口、內(nèi)表面等)�、材料、制作過程等��。
(3)使用者清潔和消毒:應(yīng)當明確推薦的清洗和消毒工藝(方法和參數(shù))����、工藝的確定依據(jù)以及驗證的相關(guān)研究資料。
(4)殘留毒性:若產(chǎn)品經(jīng)滅菌或消毒后可能產(chǎn)生殘留物質(zhì),應(yīng)當對滅菌或消毒后的產(chǎn)品進行殘留毒性的研究����,明確殘留物信息及采取的處理方法,并提供相關(guān)研究資料���。例如EO(環(huán)氧乙烷)滅菌應(yīng)考慮EO����、ECH(2-氯乙醇)殘留�。
(5)以非無菌狀態(tài)交付,且使用前需滅菌的醫(yī)療器械�����,應(yīng)當提供證明包裝能減少產(chǎn)品受到微生物污染的風(fēng)險,且適用于生產(chǎn)企業(yè)規(guī)定滅菌方法的研究資料��。
3.7模型試驗研究
申請人可通過模型試驗對產(chǎn)品的安全有效性進行確認�����。對于手術(shù)機器人�,與臨床使用相關(guān)的主要是操控性能���、手術(shù)效果����、手術(shù)安全性的評價��,操控性能評價需考慮的因素包括組織器官類型����,手術(shù)動作(縫合、切割��、抓取等)��、手術(shù)空間和機械臂擺位等問題���。手術(shù)效果的評價通常包括手術(shù)成功率����、手術(shù)時間、出血量等�����,手術(shù)安全性評價主要是術(shù)中不良事件發(fā)生率�����。
申請人可通過患者模型對手術(shù)機器人操控性能和部分手術(shù)效果及安全性進行評價��,選擇的患者模型應(yīng)盡可能準確表達人體解剖結(jié)構(gòu)��、組織特性以及疾病特性���,最大程度復(fù)現(xiàn)臨床手術(shù)風(fēng)險����,同時考慮通過智能化設(shè)計對操控性能進行客觀量化評價�,申請人應(yīng)對模型的適宜性(材質(zhì)、結(jié)構(gòu)����、臨床風(fēng)險復(fù)現(xiàn)等)進行說明��。模型試驗可根據(jù)手術(shù)機器人擬申請的適用范圍選擇典型術(shù)式開展��,模型試驗樣本量根據(jù)臨床適用范圍確定,應(yīng)能模擬臨床常用操作和最難操作, 選取已上市產(chǎn)品作為對照組,并選取不同操作者開展試驗����,典型術(shù)式參考臨床試驗和動物試驗要求�。
申請人首個產(chǎn)品申請上市時��,需要提交臨床試驗資料�����,模型試驗可在設(shè)計開發(fā)過程用于產(chǎn)品性能評估����,注冊時是否提交模型研究不做要求。產(chǎn)品變更如涉及操控性能和手術(shù)效果評價�,建議開展模型試驗研究并提交研究資料。
3.8動物試驗研究
腹腔內(nèi)窺鏡手術(shù)系統(tǒng)首次申請上市時�,以及產(chǎn)品變更涉及手術(shù)安全性和手術(shù)效果評價時,在臨床評價前��,通常需開展動物試驗。產(chǎn)品變更如不涉及手術(shù)安全性和手術(shù)效果評價時�,可不開展動物試驗,采用模型試驗評價��。申請人可參考《醫(yī)療器械動物試驗研究注冊審查指導(dǎo)原則 第一部分:決策原則(2021年修訂版)》決策是否開展動物試驗�����。
動物試驗研究資料應(yīng)當包括試驗?zāi)康?、實驗動物信息、受試器械和對照信息���、動物?shù)量���、評價指標和試驗結(jié)果、動物試驗設(shè)計要素的確定依據(jù)等內(nèi)容�����。應(yīng)基于動物試驗?zāi)康脑O(shè)計動物試驗方案���,當需要通過動物試驗研究證明產(chǎn)品的安全有效性時�����,動物試驗要求可參考附件4�。
鼓勵申請人采用科學(xué)原則進行設(shè)計確認,如已有的研究資料能夠證明申報產(chǎn)品的安全有效性��,申請人無需額外開展本要點要求的模型研究和動物試驗研究���。
3.9穩(wěn)定性研究
3.9.1 貨架有效期
產(chǎn)品組成中如含有無菌提供的手術(shù)器械或附件�����,例如超聲刀頭,血管閉合器���,應(yīng)當提供貨架有效期和包裝研究資料�����,可通過對產(chǎn)品和包裝進行加速老化和/或?qū)崟r老化試驗�����,試驗后對產(chǎn)品進行性能�����、功能和無菌檢測����,對包裝外觀、完整性��、密封性進行檢測���,證明產(chǎn)品在有效期內(nèi)保持無菌且性能功能符合預(yù)期要求�����?���?蓞⒖肌稛o源植入性醫(yī)療器械穩(wěn)定性研究指導(dǎo)原則》(2022年修訂版)�。
3.9.2 使用穩(wěn)定性
不同產(chǎn)品影響使用穩(wěn)定性的因素不同,對于手術(shù)系統(tǒng)���,需分別規(guī)定各個組成部分的有效期并提供相應(yīng)的研究資料�。對于有限次重復(fù)使用且使用前需要滅菌的器械�,例如內(nèi)窺鏡和手術(shù)器械,其使用穩(wěn)定性主要取決于耐受的滅菌次數(shù)�,其使用次數(shù)研究通常與滅菌耐受性研究合并進行����,通過對手術(shù)器械模擬多次使用��、清潔�、消毒滅菌后,對產(chǎn)品性能和安全進行測試�,證明產(chǎn)品的性能功能滿足使用要求。
對于手術(shù)系統(tǒng)中的其他組成部分�,例如醫(yī)生控制臺、患者手術(shù)平臺等�,其使用穩(wěn)定性需要考慮使用的影響、環(huán)境的影響等多種因素����,可通過可靠性測試進行驗證���。通過對產(chǎn)品進行老化/疲勞試驗�����,試驗后對產(chǎn)品性能����、功能和電氣安全進行檢驗,證明器械在聲稱的有效期內(nèi)����,在正常使用、維護和校準(如適用)情況下�����,產(chǎn)品的性能功能滿足使用要求�。設(shè)備中如包含可更換的部件或附件,應(yīng)對更換周期進行研究��,同時在說明書和標簽中明確產(chǎn)品的使用期限��,可更換部件的更換周期���、產(chǎn)品保養(yǎng)及維護方法��。有效期的試驗方法和試驗報告可參考《有源醫(yī)療器械使用期限注冊技術(shù)審查指導(dǎo)原則》�����。
使用穩(wěn)定性研究還包括不同工作環(huán)境下的穩(wěn)定性研究�,可參考GB/T 14710-2009 開展。
3.9.3 運輸穩(wěn)定性
應(yīng)當提供運輸穩(wěn)定性和包裝研究資料�,證明在生產(chǎn)企業(yè)規(guī)定的運輸條件下,運輸過程中的環(huán)境條件(例如:震動�����、振動���、溫度和濕度的波動)不會對醫(yī)療器械的特性和性能�,包括完整性和清潔度���,造成不利影響�。
運輸穩(wěn)定性通常通過模擬運輸試驗進行�,通過模擬在貯存和運輸?shù)倪^程中,遇到極端情況時�����,例如環(huán)境(溫度�����、濕度����、氣壓等)變化、跌落����、碰撞、振動��、加速度等��,產(chǎn)品不會發(fā)生性能�、功能改變,包裝系統(tǒng)具有保護產(chǎn)品的能力��。經(jīng)過模擬試驗后�����,觀察包裝外觀是否有不可接受的異?��,F(xiàn)象����,測試產(chǎn)品性能功能是否符合要求��,證明運輸過程中的環(huán)境條件不會對醫(yī)療器械的特性和性能,包括完整性和清潔度�,造成不利影響。運輸穩(wěn)定性可參考GB/ T 14710或GB/T 4857系列標準的要求進行����,也可以參考相應(yīng)的國際標準,運輸貯存環(huán)境應(yīng)與申請人產(chǎn)品說明書中規(guī)定的條件一致���。
3.10人因設(shè)計/可用性研究
手術(shù)系統(tǒng)在醫(yī)療器械中屬于操控相對復(fù)雜的器械�,且其操控性對于產(chǎn)品的安全有效性至關(guān)重要�����,為高使用風(fēng)險器械���,可用性研究也因此顯得尤為重要�����?���?捎眯允侵割A(yù)期用戶在預(yù)期使用場景下正常使用醫(yī)療器械時����,保證醫(yī)療器械安全使用的用戶接口(用戶界面)易用特性。用戶接口是指用戶與醫(yī)療器械人機交互的全部對象及方式�����,包括醫(yī)療器械的形狀尺寸����、顯示反饋、連接組裝�、操作控制、說明書與標簽���、包裝����、用戶培訓(xùn)材料等��,可用性研究可參考YY/T 1474 醫(yī)療器械 可用性工程對醫(yī)療器械的應(yīng)用����、YY/T 9706.106 醫(yī)用電氣設(shè)備 第1-6部分:基本安全和基本性能的通用要求 并列標準:可用性IEC 62366-1 Medical device-Part 1 :Application of usability engineering to medical device、IEC TR 62366-2 Medical device-Part 2 :Guidance on the application of engineering to medical device�、美國FDA指南Applying Human Factors and Usability Engineering to Medical Devices����。通過可用性研究��,識別和評估所有與使用相關(guān)的風(fēng)險�,確認所有剩余風(fēng)險是可接受的。我國組織起草的《醫(yī)療器械人因設(shè)計技術(shù)審查指導(dǎo)原則》已完成公開征求意見��,相關(guān)人員可關(guān)注后續(xù)發(fā)布通知����。
可用性測試是指在實驗室、模擬使用環(huán)境����、真實使用環(huán)境開展的用戶接口測試,包括申請人的模擬使用測試���、可用性實驗室的檢驗測試�����、真實使用環(huán)境的現(xiàn)場測試���,也可與已上市同類醫(yī)療器械開展可用性對比測試�����。
3.11注冊單元
通常與手術(shù)系統(tǒng)存在物理連接或者電氣連接的專用的部件或者附件可以與手術(shù)系統(tǒng)作為同一注冊單元,例如通過機械臂控制的內(nèi)窺鏡和手術(shù)器械均可與手術(shù)系統(tǒng)作為一個注冊單元��。
與手術(shù)系統(tǒng)不存在物理連接或者電氣連接的部件或附件不與該手術(shù)系統(tǒng)作為一個注冊單元���,例如傳統(tǒng)的穿刺用器械或其他不通過機械臂控制的手術(shù)器械或附件�。對于在臨床中共同使用���,與手術(shù)系統(tǒng)連接的通用設(shè)備���、能量平臺,則不與該系統(tǒng)作為同一個注冊單元����,例如內(nèi)窺鏡冷光源、高頻手術(shù)設(shè)備��、超聲切割止血設(shè)備等���,與手術(shù)系統(tǒng)連接使用的手術(shù)器械也可單獨注冊��。
手術(shù)過程中覆蓋手術(shù)系統(tǒng)用的一次性使用無菌保護套不與手術(shù)系統(tǒng)作為一個注冊單元��。
配合使用的通用三維腹腔內(nèi)窺鏡以及其圖像處理主機���,不與手術(shù)系統(tǒng)作為一個注冊單元�。但如果三維內(nèi)窺鏡和圖像處理主機(可集成冷光源)為手術(shù)系統(tǒng)專用��,則可作為一個注冊單元�。
當控制系統(tǒng)與手術(shù)器械、內(nèi)窺鏡或附件不作為一個注冊單元時��,需在控制系統(tǒng)的適用范圍中明確“需與已獲準配合使用的手術(shù)器械���、內(nèi)窺鏡及附件配合使用”�。內(nèi)窺鏡����、手術(shù)器械及其他附件適用范圍中需明確配合使用的控制系統(tǒng)的生產(chǎn)企業(yè)、名稱及型號�。
(三) 臨床試驗資料
1.臨床試驗?zāi)康?/p>
為確認腹腔內(nèi)窺鏡手術(shù)系統(tǒng)輔助醫(yī)生開展手術(shù)的安全性和有效性,可采取多種方法��,包括模型試驗、動物試驗和臨床試驗等�����。注冊申請人在充分的模型試驗���、動物試驗確認產(chǎn)品性能和安全性的基礎(chǔ)上��,科學(xué)合理的開展臨床試驗設(shè)計�。此時���,臨床試驗?zāi)康臑榇_認產(chǎn)品輔助醫(yī)生開展腔鏡手術(shù)的有效性和安全性。
2.臨床試驗總體設(shè)計
腹腔內(nèi)窺鏡手術(shù)系統(tǒng)為通用手術(shù)工具類產(chǎn)品�,輔助醫(yī)生完成手術(shù)操作,常用于泌尿外科�����、普通外科���、婦科和胸外科(以下簡稱“臨床常見科室”)腔鏡手術(shù)��。產(chǎn)品注冊時�����,注冊申請人可在上述科室選擇代表性的常見術(shù)式開展臨床試驗�����,用于支持臨床常見科室的注冊申報���。臨床試驗可采用前瞻性����、單組目標值設(shè)計�。
3.入排標準
受試者是經(jīng)過培訓(xùn)的醫(yī)生按照臨床診療規(guī)范確定的、擬接受腹腔內(nèi)窺鏡手術(shù)系統(tǒng)輔助進行泌尿�����、普外�����、婦科和胸外代表性術(shù)式的患者���。其他入選標準和排除標準的具體內(nèi)容由申辦方和研究者具體討論決定���。
4.評價指標和隨訪時間
(1)主要終點
主要有效性終點是手術(shù)未中轉(zhuǎn)率�����,將“手術(shù)未中轉(zhuǎn)”定義為未從腹腔內(nèi)窺鏡手術(shù)系統(tǒng)輔助方法轉(zhuǎn)換為其他腹腔內(nèi)窺鏡手術(shù)系統(tǒng)輔助���、腹腔鏡下手術(shù)或者開放性手術(shù)。
主要安全性終點是從第一個切口到術(shù)后30天符合Clavien-Dindo分級系統(tǒng)3級或以上標準的與器械相關(guān)的或可能相關(guān)的并發(fā)癥發(fā)生率�。
(2)次要終點
包括手術(shù)時間、術(shù)中估計失血量(mL)�、患者疼痛評分、輸血率����、器械缺陷發(fā)生率��、住院時間���、從第一個切口到術(shù)后30天的整體并發(fā)癥發(fā)生率(Clavien-Dindo 1級或以上)����、不良事件和嚴重不良事件發(fā)生率以及30天內(nèi)再入院率�、再次手術(shù)率和死亡率等。
5.臨床試驗樣本量
臨床試驗開始前,注冊申請人需全面收集具有一定質(zhì)量水平及相當數(shù)量病例的同類產(chǎn)品的臨床數(shù)據(jù)����,經(jīng)科學(xué)分析(如Meta分析等),構(gòu)建臨床試驗的目標值(性能目標)�,包括靶值和單側(cè)置信區(qū)間界限(通常為97.5%單側(cè)置信區(qū)間界限)。注冊申請人需提交目標值的確定依據(jù)和支持性資料�。
例如,若經(jīng)過科學(xué)分析�����,該類產(chǎn)品在臨床常見科室手術(shù)未發(fā)生中轉(zhuǎn)的比例可接受的最低標準為90%�,申報產(chǎn)品預(yù)期手術(shù)未發(fā)生中轉(zhuǎn)的比例為99%,在雙側(cè)顯著性水平0.05��、把握度80%���、脫落率10%時���,采用精確概率法進行樣本量估算,臨床試驗的樣本量為60例����。若行業(yè)可接受該類產(chǎn)品在臨床常見科室的術(shù)后30天Clavien-Dindo3級或以上標準的并發(fā)癥發(fā)生率最低標準為16%����,申報產(chǎn)品上述并發(fā)癥預(yù)期發(fā)生率為3%����,在雙側(cè)顯著性水平0.05、把握度80%��、脫落率10%時�,采用精確概率法進行樣本量估算,臨床試驗的樣本量為48例�。綜上,臨床試驗的樣本量為60例�����。
當注冊申請人已通過臨床試驗確認該產(chǎn)品在一定適用范圍(如泌尿外科�,普外科特定術(shù)式)內(nèi)的有效性和安全性后�����,若在已有適用范圍上增加預(yù)期使用科室時�����,鼓勵申請人通過非臨床研究、臨床試驗確認產(chǎn)品的安全有效性����,單科室臨床試驗的樣本量建議為15例左右。
6.臨床試驗術(shù)式
臨床試驗需覆蓋適用范圍內(nèi)的常見代表性術(shù)式�����。代表性術(shù)式通常為更高風(fēng)險/更復(fù)雜的術(shù)式���,對申報科室常見術(shù)式所能到達的手術(shù)工作區(qū)�����、目標組織類型(如實質(zhì)組織����、空腔組織�、脈管組織等)及其涵蓋的手術(shù)任務(wù)(如抓取、切割�����、縫合����、凝結(jié)��、牽引���、剝離、結(jié)扎等)具有覆蓋性����。
注冊申請人申請臨床常見科室時,臨床試驗中需包括:(1)泌尿外科:腎部分切除術(shù)(經(jīng)腹腔或后腹膜)���、根治性前列腺切除術(shù)�����;(2)婦科:子宮根治性切除術(shù)加盆腔淋巴結(jié)清掃術(shù)�;(3)普通外科:遠端胃癌根治術(shù)�����、結(jié)直腸癌根治術(shù)���、肝切除術(shù)/脾切除術(shù)��;(4)胸外科:肺段/肺葉切除術(shù)�����、食管癌根治術(shù)等��。
各科室樣本量分布需基本均衡����。已上市產(chǎn)品增加預(yù)期使用科室時��,可參考上述要求選擇代表性術(shù)式���。若注冊申請人采取其他代表性術(shù)式���,需基于前述代表性術(shù)式的定義論證其合理性。
7.統(tǒng)計分析
可參考《醫(yī)療器械臨床試驗設(shè)計指導(dǎo)原則》對臨床試驗結(jié)果進行統(tǒng)計分析�����,得出結(jié)論����。
(四)產(chǎn)品說明書和標簽樣稿
說明書��、標簽樣稿應(yīng)當符合《醫(yī)療器械說明書和標簽管理規(guī)定》及其他適用法規(guī)�����、標準�、指導(dǎo)原則����、審評要點中有關(guān)說明書和標簽要求的規(guī)定,應(yīng)包括機械臂振動振幅�、末端振動振幅和時間、主從操作精度(準確度����、重復(fù)性)、運動范圍(有效工作空間)等性能指標要求����。說明書還應(yīng)簡要描述已開展的模型試驗、動物試驗研究概述�,包括試驗術(shù)式、樣本量����、試驗結(jié)果等��。
注冊申請人需在產(chǎn)品說明書提供臨床試驗基本信息,包括臨床試驗?zāi)康?���、試驗設(shè)計、受試人群���、樣本量�����、手術(shù)術(shù)式以及各術(shù)式病例數(shù)���、評價指標、試驗結(jié)果(包括手術(shù)未中轉(zhuǎn)率�、手術(shù)時間、術(shù)中估計失血量(mL)���、輸血率�、不良事件發(fā)生情況等)����。
注冊申請人需在說明書進行如下說明���,該產(chǎn)品在其適用范圍下的安全有效性是基于其作為手術(shù)工具的評估,不包括惡性腫瘤相關(guān)臨床結(jié)局評估��,如惡性腫瘤的治療效果(總生存率��、無病生存率�、局部復(fù)發(fā)等) 。
注冊申請人需在說明書中明確該產(chǎn)品只有經(jīng)過培訓(xùn)且考核合格的醫(yī)生才能使用本產(chǎn)品����。考慮到長時間注視三維腹腔內(nèi)窺鏡的顯示器可能導(dǎo)致部分醫(yī)生出現(xiàn)頭暈��、惡心等癥狀����,注冊申請人還需在說明書中明確如有癲癇等病史的醫(yī)生建議謹慎使用。
注冊申請人在說明書中除明確基本的安裝和使用說明外��,需明確與該類產(chǎn)品設(shè)計相關(guān)的特別注意事項���,如本產(chǎn)品的力反饋與使用普通胸腹腔鏡的力反饋不同�����,醫(yī)生須依靠視覺提示來增強力反饋等��。
注冊申請人需在說明書中提示可能轉(zhuǎn)開放手術(shù)的情況���,并將相應(yīng)風(fēng)險告知患者。注冊申請人還需在產(chǎn)品說明書中明確患者擺位和體腔切口規(guī)劃等信息�����。
(五)體系考核關(guān)注點
關(guān)注變更(軟件變更�����、與運動控制相關(guān)的關(guān)鍵元器件�、生產(chǎn)工藝等)是否符合GMP以及法規(guī)要求。
(六)審評報告注意事項
1.產(chǎn)品名稱
產(chǎn)品組成中如包含手術(shù)器械�����,產(chǎn)品名稱通?���?擅麨椤案骨粌?nèi)窺鏡手術(shù)系統(tǒng)”;產(chǎn)品組成中如不包含手術(shù)器械,僅包括醫(yī)生控制臺�����、患者手術(shù)平臺和影像處理平臺基本配置�,產(chǎn)品名稱可命名為“腹腔內(nèi)窺鏡手術(shù)器械控制系統(tǒng)”。如產(chǎn)品不屬于GB 9706.1中“ME系統(tǒng)”范疇����,則產(chǎn)品名稱命名為“腹腔內(nèi)窺鏡手術(shù)設(shè)備”或“腹腔內(nèi)窺鏡手術(shù)器械控制設(shè)備”。如產(chǎn)品適用范圍同時包含腹腔內(nèi)窺鏡手術(shù)和胸腔內(nèi)窺鏡手術(shù),可命名為"胸腹腔內(nèi)窺鏡手術(shù)系統(tǒng)”����、“胸腹腔內(nèi)窺鏡手術(shù)設(shè)備”或“胸腹腔內(nèi)窺鏡手術(shù)器械控制系統(tǒng)”。
2.結(jié)構(gòu)組成
醫(yī)療器械注冊證產(chǎn)品結(jié)構(gòu)組成一欄可描述為由醫(yī)生控制臺�����、患者手術(shù)平臺�、影像處理平臺(如有)、三維腹腔內(nèi)窺鏡(如有)�����、手術(shù)器械以及附件組成�,但同時在注冊證附件中以列表的形式明確系統(tǒng)組件中每個組成部分的規(guī)格型號和所包含的組成�����,在綜述資料中詳述每個組成部分的功能�����,附件中結(jié)構(gòu)組成描述舉例見表1����。附件可包括可插拔的線纜�����、轉(zhuǎn)接頭����、一次性使用絕緣套等�。如含有一次性使用的或無菌提供的產(chǎn)品組成,應(yīng)明確���。產(chǎn)品組成中如包含血管閉合器�����、超聲手術(shù)刀頭���,應(yīng)在手術(shù)器械列表中明確其配合使用的主機����,配用的主機應(yīng)經(jīng)過驗證��。
表1 產(chǎn)品結(jié)構(gòu)組成列表示例
組件名稱 | 規(guī)格型號 | 組成部分 |
醫(yī)生控制臺 | *** | 包括手動控制器���、腳踏面板����、3D觀察器等�。 |
患者手術(shù)平臺 | *** | 包括基座、手柄����、支柱、吊桿��、機械臂等��。 |
影像處理平臺 | *** | 包括內(nèi)窺鏡圖像處理裝置��、觸摸屏、臺車等���。 |
三維腹腔內(nèi)窺鏡 | *** | 包括頭端部�����、插入部��、接口部分等 |
以上僅為舉例��,注冊時應(yīng)根據(jù)產(chǎn)品實際情況明確產(chǎn)品組成��,不含有“等”字樣表述
��。對于手術(shù)器械,建議在產(chǎn)品技術(shù)要求中按無源手術(shù)器械和有源手術(shù)器械分別列表明確��,格式舉例見表2����。
表2 手術(shù)器械列表舉例
器械 名稱 | 規(guī)格型號 | 提供 方式 | 貨架壽命/使用次數(shù) | 功能 描述 | 頭端 圖示 |
持針鉗 | **** | 非無菌 | 10次 | 用于持針進行縫合。 |
|
一次性使用血管閉合器 | *** | 環(huán)氧乙烷滅菌 | 3年 | 與***主機配合使用�����,用于閉合直徑不超過**mm血管的。 |
|
五��、《醫(yī)療器械安全和性能基本原則清單》各項內(nèi)容的適用
性六���、其他
產(chǎn)品組成中的無源手術(shù)器械和高頻手術(shù)器械的注冊申報資料可參考《腹腔內(nèi)窺鏡手術(shù)系統(tǒng)注冊審查指導(dǎo)原則第1部分:手術(shù)器械》�����,超聲刀頭注冊申報資料可參考《超聲軟組織手術(shù)設(shè)備注冊審查指導(dǎo)原則》(2023年修訂版)����。