新的醫(yī)療器械法規(guī)(2017/745 / EU)(MDR)和體外診斷醫(yī)療器械法規(guī)(2017/746 / EU)(IVDR)使歐盟立法與技術進步�����,醫(yī)學科學變革和進步在法律制定上保持一致���。新法規(guī)將建立一個健全����,透明����,可持續(xù)的監(jiān)管框架����,得到國際認可�,可提高臨床安全性并為制造商創(chuàng)造公平的市場準入�����。與指令不同�,法規(guī)不需要轉變?yōu)閲曳āat(yī)療器械CE認證升級也將發(fā)生重大變化����。
新的醫(yī)療器械法規(guī)(2017/745 / EU)(MDR)和體外診斷醫(yī)療器械法規(guī)(2017/746 / EU)(IVDR)使歐盟立法與技術進步,醫(yī)學科學變革和進步在法律制定上保持一致����。新法規(guī)將建立一個健全,透明���,可持續(xù)的監(jiān)管框架���,得到國際認可,可提高臨床安全性并為制造商創(chuàng)造公平的市場準入���。與指令不同�����,法規(guī)不需要轉變?yōu)閲曳?��。以下?a href="http://manplanetcorporation.com/service_show.aspx?id=6" target="_self" style="font-family: 微軟雅黑, "Microsoft YaHei"; font-size: 14px; white-space: normal; text-decoration-line: none; cursor: pointer; text-indent: 32px; background-color: rgb(255, 255, 255);">醫(yī)療器械CE認證升級相關介紹:
醫(yī)療器械法規(guī)(MDR)的背景
MDR將取代現(xiàn)有的醫(yī)療器械指令(93/42/EEC)(MDD)和主動植入式醫(yī)療器械指令(90/385/EEC) (AIMDD)���。MDR于2017年5月發(fā)布,標志著MDD和AIMDD之間為期三年的過渡期的開始��。
在過渡期間�,MDR將逐步生效,首先是與指定公告機構和制造商根據MDR申請新證書的能力有關的規(guī)定�。
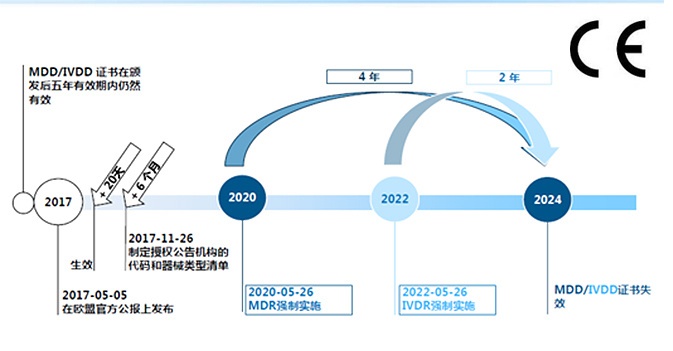
過渡期將于2020年5月26日,即MDR法規(guī)的“適用日期”(DoA)結束���。從那時起�,MDR將完全適用�。
1. MDR適用范圍
MDR的范圍已經擴大了,因此作為制造商�����,您必須檢查您的產品組合,以確定與指令相比����,是否有更多的設備屬于法規(guī)的范圍�。注意附件十六所列的產品,這些產品一旦通過載列共同規(guī)格的實施細則��,就會納入本規(guī)例�����。不屬于本范圍的產品清單見第6段���。
2. 制造商的義務
經銷商����,制造商�,進口商等的義務及其關系現(xiàn)已在該條例中明確規(guī)定。
第10條制造商應有風險管理制度(第2款)和質量管理制度(第9款);進行臨床評估(第3段);編寫技術文件(第4段);�,并采用合格評定程序(第6段)。制造商亦須對其產品在市場上銷售后負責(第12���、13�、14段)。它們必須有適當?shù)闹贫葋韽浹a它們對有缺陷的裝置造成的損害所負的財務責任(第16段)����。
每個制造商應指定一名負責合規(guī)的人員(第15條)。
一些可植入設備的制造商必須為患者提供植入卡(第18條)�。
一旦制造商完成所有這些義務,他們應制定一份符合性聲明(第19條)�����,并在其設備上應用CE標記(第20條)�����。
歐盟/歐洲經濟區(qū)以外的制造商應與歐盟/歐洲經濟區(qū)內的授權代表簽訂合同(第11條)�。
授權代表(第11條)、進口商(第13條)和分銷商(第14條)的義務也作了明確說明���。
3. 公告機構NB
根據MDR新規(guī)定�����,必須指定公告機構����。醫(yī)療器械將被要求滿足更嚴格的標準,特別是在臨床能力方面����。公告機構可于2017年11月26日起指定申請。指定的過程可能需要12個月或更長時間�,包括來自不同國家和歐洲當局的評估人員。這意味著���,根據新規(guī)定指定的首批公告機構可能在2018年底前到位。
4. 合格評定
根據某些裝置的危險類別和具體特征�����,對符合CE標志的裝置的評價各不相同(第五十二條)���。所有IIa�����、IIb和III類設備以及一些特定的I類設備都需要一個通知機構的干預(見第7a5��、b6和c7段)����。第52條和附件九、十�、習敘述了根據設備類別不同的評估方法。在某些情況下���,制造商對合格評定路線有一些選擇�����。
對于某些III類和IIb類設備����,有一個新的臨床評估咨詢程序�����,該程序將由一個獨立的專家組根據該公告機構的臨床評估評估報告進行(第五十四條)���。
附件一規(guī)定了一般的安全和性能要求�����,附件二和三規(guī)定了技術文件的組成�����。
質量管理體系的范圍(第10條第9款)包括臨床評價和上市后臨床隨訪���。臨床評價計劃必須先于臨床評價本身(附件十四�����,A部分)�����。
可以為某些設備制定確定附加要求的通用規(guī)范(第9條)。
5. 醫(yī)療器械法規(guī)(MDR)何時適用
MDR(EU)2017/745將于2020年5月26日起申請 - “申請日期”(DoA)���。
MDR的某些條款將提前生效(例如關于公告機構和醫(yī)療器械協(xié)調組)�����。 有些將在稍后申請(例如關于UDI標簽)����。
現(xiàn)有指令什么時候停止適用�?
一般而言,指令90/385 / EEC和93/42 / EEC將于2020年5月26日(DoA)廢除����。
設備和制造商都必須遵守MDR�。 您應該評估設備的符合性 - 這可能需要公告機構的參與����。
其他重點包括:
?臨床評估
? 風險管理
?質量管理體系(QMS)
?上市后監(jiān)督
?技術文檔和其他報告
?有缺陷設備的責任。
6. 在DoA之后��,現(xiàn)有指令下的公告機構頒發(fā)的證書是否仍然有效��?
是的��,AIMDD / MDD證書通常在指定的到期日之前有效���。 這適用于通知機構通常頒發(fā)的所有證書�,包括EC設計檢驗證書�����,合格證書�����,EC型式檢驗證書�����,EC證書全面質量保證體系和EC證書生產質量保證。
但是���,所有在2017年5月25日之后簽發(fā)的證書最遲在2024年5月27日之前無效����。在此日期之后�����,將不再有效的AIMDD / MDD證書�。
是否可以在2024年5月27日之前同時獲得有效的MDR和AIMDD / MDD證書?
是���。
在過渡期結束后,制造商是否仍然可以投放市場/投入使用符合指令的設備�����?
是的����,在某些條件下��,可以選擇繼續(xù)投放市場/投入使用符合指令的設備�����,直到其現(xiàn)有證書到期為止�����。 這可以避免在MDR下立即需要新證書����。
要使用此選項�����,所有現(xiàn)有證書必須有效(例如�����,QMS)�����,設備的目的和性質不得更改��,并且您必須遵循新的MDR規(guī)則進行注冊,監(jiān)視和警惕��。