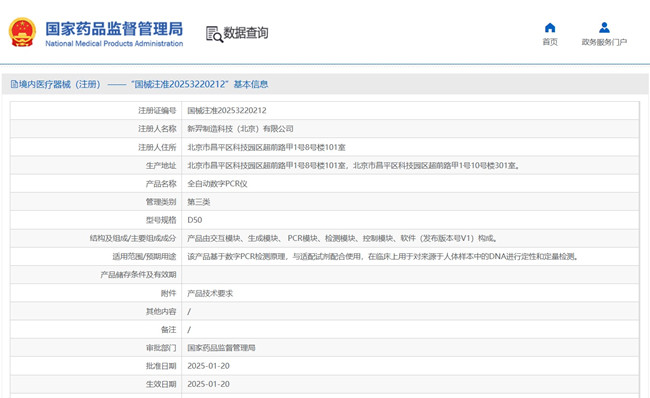
?全自動數(shù)字 PCR 儀在我國屬于第三類醫(yī)療器械注冊產(chǎn)品�,且不在免于醫(yī)療器械臨床試驗(yàn)?zāi)夸浿畠?nèi)����。該產(chǎn)品基于數(shù)字PCR 檢測原理,與適配試劑配合使用��,在臨床上用于對來源于人體樣本中的DNA進(jìn)行定性和定量檢測����。本文為大家介紹全自動數(shù)字PCR儀臨床試驗(yàn)設(shè)計(jì)實(shí)例,一起看正文�����。
全自動數(shù)字 PCR 儀在我國屬于第三類醫(yī)療器械注冊產(chǎn)品���,且不在免于醫(yī)療器械臨床試驗(yàn)?zāi)夸浿畠?nèi)。該產(chǎn)品基于數(shù)字PCR 檢測原理����,與適配試劑配合使用,在臨床上用于對來源于人體樣本中的DNA進(jìn)行定性和定量檢測。本文為大家介紹全自動數(shù)字PCR儀臨床試驗(yàn)設(shè)計(jì)實(shí)例����,一起看正文。
一��、全自動數(shù)字PCR儀產(chǎn)品工作原理
本產(chǎn)品與配套的微流控芯片配合使用�����,工作原理包括芯片
上樣���、液滴生成���、核酸擴(kuò)增、液滴檢測���、廢料轉(zhuǎn)移等環(huán)節(jié)���。
芯片上樣:操作軟件,將芯片進(jìn)樣倉彈出�,把含有待測樣
本的反應(yīng)體系的芯片放入后,關(guān)閉進(jìn)樣倉���,芯片將由調(diào)度系統(tǒng)
掃描和識別�,完成芯片上樣。在實(shí)驗(yàn)啟動后����,儀器會不斷將進(jìn)
樣倉上的芯片取走,進(jìn)入后續(xù)流程�。只要進(jìn)樣倉有空位,就可
以隨時(shí)加入新的芯片���。
液滴生成:芯片由調(diào)度系統(tǒng)抓取到生成模塊進(jìn)行液滴生成操作���。生成模塊在氣路的作用下將芯片中的反應(yīng)體系和微液滴
生成油驅(qū)動進(jìn)入芯片內(nèi)的液滴生成結(jié)構(gòu),在流體張力和剪切力
作用下�����,反應(yīng)體系周期斷裂��,生成尺寸均一的液滴��。生成的液
滴儲存在芯片的反應(yīng)管中�。
核酸擴(kuò)增:完成液滴生成后���,調(diào)度系統(tǒng)將芯片進(jìn)行翻轉(zhuǎn)�,
并放入 PCR 模塊中進(jìn)行 PCR 溫度循環(huán)。PCR 模塊按照設(shè)定的
程序����,對位于芯片反應(yīng)管中的液滴進(jìn)行溫度循環(huán)控制,使得液
滴內(nèi)的靶基因在 PCR 反應(yīng)下不斷實(shí)現(xiàn)核酸擴(kuò)增����。
液滴檢測:擴(kuò)增完的芯片由調(diào)度系統(tǒng)轉(zhuǎn)移到檢測模塊。檢
測模塊內(nèi)依次向芯片上的每個(gè)樣本注入檢測油�。在檢測油的驅(qū)
動下,反應(yīng)管內(nèi)的液滴重新進(jìn)入芯片管道���。在驅(qū)動油的和芯片
管道的作用下����,液滴形成有序的液滴隊(duì)列���,依次經(jīng)過檢測區(qū)���,在檢測區(qū)對依次經(jīng)過的每一個(gè)液滴進(jìn)行熒光激發(fā)。每個(gè)液滴中
的熒光染料經(jīng)激光照射后發(fā)射出特定波長的熒光��。激發(fā)的熒光
被分到不同的光電信號轉(zhuǎn)換傳感器,光信號轉(zhuǎn)換成電信號����,傳
給上位機(jī)系統(tǒng)并繪制成熒光散點(diǎn)圖。軟件依據(jù)液滴信號劃分陰
陽性���,并通過數(shù)學(xué)模型精準(zhǔn)計(jì)算出樣本中模板的拷貝數(shù)�,通過
儀器配備的觸摸屏呈現(xiàn)給用戶���。
廢料轉(zhuǎn)移:芯片檢測完成后被轉(zhuǎn)移到廢料倉�����。在所有處理的過程中���,芯片始終保持密封狀態(tài),樣本的泄漏污染風(fēng)險(xiǎn)低���。
廢料箱可通過儀器面板打開�,將廢料清空后放回儀器���。
二����、全自動數(shù)字PCR儀臨床試驗(yàn)設(shè)計(jì)實(shí)例
本次臨床試驗(yàn)在五家臨床試驗(yàn)機(jī)構(gòu)進(jìn)行�。臨床試驗(yàn)選擇兩個(gè)具有代表性的項(xiàng)目驗(yàn)證申報(bào)產(chǎn)品針對來源于人體樣本中的
DNA定性和定量檢測的臨床性能,所選項(xiàng)目為:人類腫瘤基因
EGFR 基因突變檢測項(xiàng)目和乙型肝炎病毒DNA定量檢測項(xiàng)目��。
針對人類腫瘤基因EGFR基因突變檢測項(xiàng)目�����,臨床試驗(yàn)納入非小細(xì)胞肺癌患者的血漿樣本���。采用申報(bào)產(chǎn)品與配套的已定型的EGFR 突變檢測試劑作為考核儀器系統(tǒng)�,采用已上市的全自動熒光PCR分析儀與配套的已上市EGFR突變檢測試劑作為
對照儀器系統(tǒng)���,采用高通量測序方法(NGS)與配套的EGFR突變檢測試劑作為臨床參考系統(tǒng)����。該試驗(yàn)共納入518 例血漿樣
本�����,陽性樣本 253 例(覆蓋點(diǎn)突變�、插入和缺失等各種變異類型�����,且每種變異類型均有一定的陽性例數(shù))����,陰性樣本 265 例���。試驗(yàn)結(jié)果顯示:考核儀器系統(tǒng)與臨床參考系統(tǒng)比較的陽性符合
率為 96.8%(95%CI:93.9%�,98.6%)�����,陰性符合率為 99.3%
(95%CI:97.3%����,99.9%),對照儀器系統(tǒng)與臨床參考系統(tǒng)比
較的陽性符合率為 89.7%(95%CI:83.5%���,91.9%)�,陰性符
合率為 98.9%(95%CI:96.7%����,99.8%)���,考核儀器系統(tǒng)檢測性能優(yōu)于對照儀器系統(tǒng)。
針對乙型肝炎病毒DNA 定量檢測項(xiàng)目���,臨床試驗(yàn)納入乙型肝炎病毒感染患者的血漿樣本。采用申報(bào)產(chǎn)品與配套的已定型
乙型肝炎病毒DNA檢測試劑作為考核儀器系統(tǒng)����,采用臨床試驗(yàn)機(jī)構(gòu)自建的數(shù)字PCR儀及其配套試劑作為臨床參考系統(tǒng)。該試驗(yàn)共納入 354 例血漿樣本����。定量統(tǒng)計(jì)分析結(jié)果顯示:考核儀器系統(tǒng)與臨床參考系統(tǒng)的相關(guān)系數(shù)為0.986,回歸方程為 y=1.068x
-0.125����,BA分析的一致性界限在臨床可接受標(biāo)準(zhǔn)內(nèi)。定性統(tǒng)計(jì)
分析結(jié)果顯示:考核儀器系統(tǒng)與臨床參考系統(tǒng)的陽性符合率為100%��,陰性符合率為100%��,總符合率100%����。
綜上所述�,該產(chǎn)品臨床試驗(yàn)設(shè)計(jì)符合《醫(yī)療器械臨床評價(jià)技術(shù)指導(dǎo)原則》的相關(guān)要求����,臨床性能滿足技術(shù)審評要求。
如有全自動數(shù)字PCR儀臨床試驗(yàn)設(shè)計(jì)或是其他醫(yī)療器械臨床試驗(yàn)服務(wù)需求���,歡迎您隨時(shí)方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò)�����,聯(lián)系人:葉工���,電話:18058734169,微信同�����。