《醫(yī)療器械監(jiān)督管理條例》第二十六條規(guī)定:開展醫(yī)療器械臨床試驗,應(yīng)當按照醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范的要求����,在具備相應(yīng)條件的臨床試驗機構(gòu)進行,并向臨床試驗申辦者所在地省�����、自治區(qū)����、直轄市人民政府藥品監(jiān)督管理部門備案。接受臨床試驗備案的藥品監(jiān)督管理部門應(yīng)當將備案情況通報臨床試驗機構(gòu)所在地同級藥品監(jiān)督管理部門和衛(wèi)生主管部門��。本文為大家介紹浙江省醫(yī)療器械臨床試驗備案流程和要求�����。
《醫(yī)療器械監(jiān)督管理條例》(中華人民共和國國務(wù)院令第739號)第二十六條規(guī)定:開展醫(yī)療器械臨床試驗�����,應(yīng)當按照醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范的要求,在具備相應(yīng)條件的臨床試驗機構(gòu)進行����,并向臨床試驗申辦者所在地省、自治區(qū)�、直轄市人民政府藥品監(jiān)督管理部門備案�����。接受臨床試驗備案的藥品監(jiān)督管理部門應(yīng)當將備案情況通報臨床試驗機構(gòu)所在地同級藥品監(jiān)督管理部門和衛(wèi)生主管部門��。本文為大家介紹浙江省醫(yī)療器械臨床試驗備案流程和要求����。
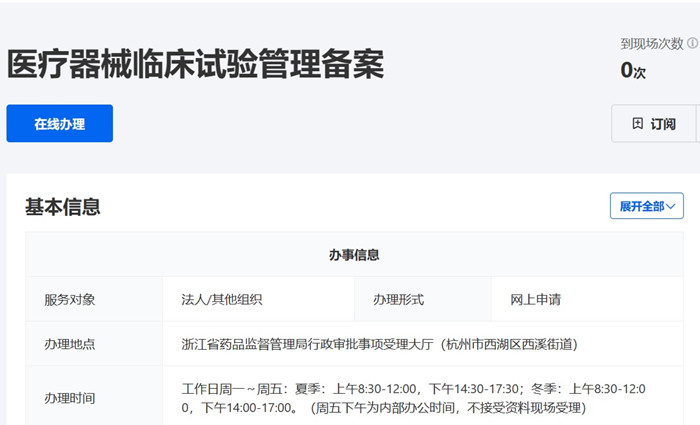
一、浙江省醫(yī)療器械臨床試驗備案受理條件
1.醫(yī)療器械臨床試驗項目經(jīng)倫理審查通過且申辦者(即醫(yī)療器械注冊申請人或代理人)與臨床試驗機構(gòu)簽訂協(xié)議或合同����。
2.按要求提交規(guī)定的申請材料并符合要求。
二�����、浙江省醫(yī)療器械臨床試驗備案流程
申請人通過省政務(wù)服務(wù)網(wǎng)網(wǎng)上申報,并提交相關(guān)電子申請材料���。申請人按照申報資料要求��,提供一套紙質(zhì)材料����,通過郵寄或直接遞交�����,或者委托相關(guān)人員遞交省藥品監(jiān)督管理局受理大廳�。

浙江省醫(yī)療器械臨床試驗備案流程和備案時間

三、浙江省醫(yī)療器械臨床試驗備案材料要求
醫(yī)療器械臨床試驗備案申請材料包括:醫(yī)療器械臨床試驗備案表�����、倫理委員會意見掃描件���、申辦者與臨床試驗機構(gòu)實施臨床試驗協(xié)議或合同的掃描件��、醫(yī)療器械臨床試驗審批意見單��、申辦者及代理人營業(yè)執(zhí)照掃描件��,具體要求如下圖所示:

如有浙江省醫(yī)療器械臨床試驗備案及醫(yī)療器械臨床試驗代理服務(wù)需求�����,歡迎您隨時方便與杭州證標客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò)�,聯(lián)系人:葉工,電話:18058734169�����,微信同��。